甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知
| 化学键 |
H-H |
C-O |
C=O |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。
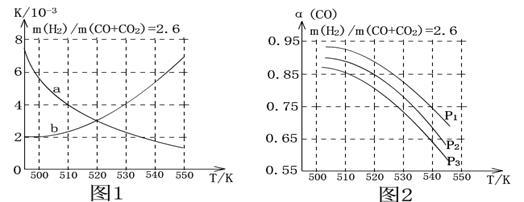
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l)△H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式:。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为(填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
(16分)尼泊金甲酯和香兰素在食品、化妆品行业有广泛用途。它们的结构简式如下:
(1)尼泊金甲酯中显酸性的官能团是__________(填名称)。
(2)下列说法中,正确的是______(填标号)。
| A.尼泊金甲酯和香兰素分子式都是C8H8O3 |
| B.尼泊金甲酯和香兰素都能发生水解反应 |
| C.1 mol尼泊金甲酯或香兰素均能与4 mol H2发生加成反应 |
| D.利用银氨溶液可以区别尼泊金甲酯和香兰素 |
(3)写出尼泊金甲酯与NaOH溶液反应的化学方程式:_________________________________。
(4)大茴香酸与香兰素互为同分异构体,它是一种羧酸,且具备以下3个特点。大茴香酸的结构简式为______________________。
a.分子中含有甲基
b.遇FeCl3溶液不显紫色
c.苯环上的一氯代物只有两种
(5)以丁香油酚为原料,通过下列路线合成香兰素。
(注:分离方法和其他产物已经略去;乙酸酐的结构简式为:(CH3CO)2O)
①由 和ClCH2CH==CH2合成丁香油酚的反应类型为____________。
和ClCH2CH==CH2合成丁香油酚的反应类型为____________。
②步骤Ⅱ中,反应的化学方程式为____________________________________。
③W的结构简式为________________。
选考(12分)【化学一物质结构与性质】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)镓的基态原子的电子排布式是__________________________。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为________(用元素符号表示)。
(3)气态SeO3分子的立体构型为____________________。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________。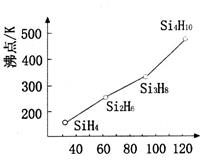
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为________________;若该晶体的边长为a cm,则该合金密度为____________g·cm-3(阿伏加德罗常数的值为NA)。
选考(12分)【化学——化学与技术】
(1)目前,我国采用“接触法”制硫酸。有关接触法制硫酸的下列说法中,正确的是_________。
| A.二氧化硫的接触氧化在转化器中发生 |
| B.吸收塔中得到的硫酸质量分数为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
| D.转化器中适宜条件是V2O5,催化剂、高温、常压 |
E.转化器中采取高温是为了提高催化剂的活性和提高SO2的转化率
(2)硫酸工厂排放的尾气中含少量二氧化硫。为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的SO2可用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程发生反应的化学方程式:_____________;
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰_____________Kg。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图所示,a、b离子交换膜将电解槽分为三个区域,电极材料为石墨。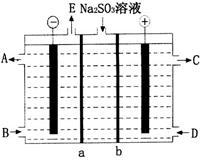
①图中b表示__________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中C为硫酸,则E表示__________;
②阳极的电极反应式为________________。
(17分)碳及其化合物与人类生产、生活密切相关。(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。
已知:C(s)+1/2O2(g)=CO(g)△H1=-126.4kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
S(s)+O2(g)=SO2(g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式为____________。
(2)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g) △H=-90.8KJ·mol-1。
CH3OH(g) △H=-90.8KJ·mol-1。
①在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是______℃;该温度下上述反应的化学平衡常数为_______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________;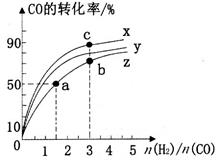
②在密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状。当改变某一反应条件后,下列变化能说明平衡一定向正反应方向移动的是______(填序号)。
| A.正反应速率瞬间增大,后逐渐减小 |
| B.混合气体的密度增大 |
| C.化学平衡常数K值增大 |
| D.反应物的体积百分含量增大 |
(3)一种新型CO燃料电池工作原理如图所示。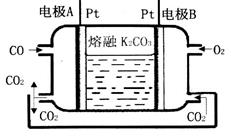
①负极电极反应式为_______________________;
②电极A处产生的CO2有部分参与循环利用,其利用率为____________。