二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ 。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。______________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: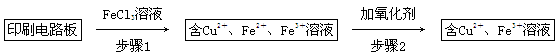
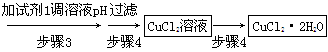
①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+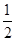 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。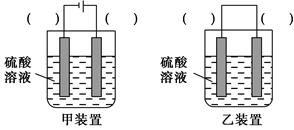
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。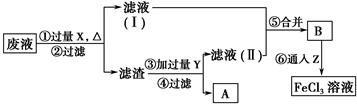
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
随着现代化工业的发展,能源问题已经越来越引起人们的重视。科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适宜的催化剂作用水解成葡萄糖,再将葡萄糖转化为乙醇,用作燃料。
(1)写出绿色植物秸秆转化为乙醇的化学方程式:
①_____________________________________________________________。
②____________________________________________________________。
(2)乙醇除用作燃料外,还可用来合成其他有机物,下列主要是以乙醇为起始原料的转化关系图。请在表中填上相应物质的结构简式。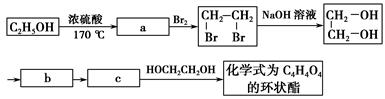
(3)写出上面关系图中由c生成C4H4O4的化学方程式。(有机物用结构简式表示)_________________________________________________________。
常用洗涤剂的主要成分是十二烷基苯磺酸钠 ,十二烷基苯磺酸钠是普通洗衣粉的主要成分。其结构可用图形
,十二烷基苯磺酸钠是普通洗衣粉的主要成分。其结构可用图形 来表示,•端为链烃基,O端为极性基。根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基。根据这一结构特点,试分析和回答下列问题:
(1)十二烷基苯磺酸钠分子在水溶液表面分布的结构示意图,应是下列各图中的________图(填写序号),理由是____________。
(2)进入水内部的十二烷基苯磺酸钠分子,可能会以下列结构形式中的________存在(填写序号)。
阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90 ℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85~90℃,应采用的加热方法是____________,用这种方法加热需要的玻璃仪器有________。
(2)在第②步中,用冷水洗涤晶体,其目的是____________、____________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是________________,加入盐酸的作用是____________。
(4)如何检验产品中是否混有水杨酸?____________。