氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O),已知氯化铜易溶于水,难溶于乙醇。

(1)溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验出溶液1中Fe2+的试剂是 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
(2)试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的(填序号) 。
A.NaOH
B.NH3·H2O
C.CuO
D.Cu2(OH) 2CO3
E.CuSO4
调节pH至4~5的原因是 。
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、 。
(4)得到CuCl2·xH2O晶体最好采用的干燥方式是 。
A.空气中加热蒸干
B.空气中低温蒸干
C.HCl气流中加热烘干
D.HCl气流中低温烘干
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。根据实验数据测得x= (用含m、n的代数式表示)。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。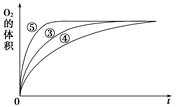
分析上图能够得出的实验结论是_____________________________________________。
阅读下列实验内容,根据题目要求回答问题。
某学生测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100.00 mL稀H2SO4溶液;取上述稀H2SO4 25.00 mL用0.14 mol·L-1的NaOH溶液滴定,消耗NaOH溶液15.00 mL。
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入2滴酚酞。
B、用待测定的溶液润洗酸式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)E→ C → D→_________→_________→_________→F;
②在G操作中如何确定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“无影响”)_________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要仪器是(写一种)_________。
(4)如有1.00 mol/L和0.10 mol/L的NaOH溶液,应用 ____________的NaOH溶液,原因是____________。
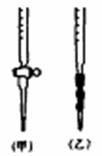
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________(选填“甲”或“乙”)中。(下图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_________(计算结果到小数点后二位)。
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):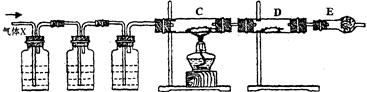
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________;
(2)乙同学认为还可能产生氢气的化学方程式是;
(3)丙同学在安装好装置后,必不可少的一步操作是:;
(4)A中加入的试剂可能是,作用是_____;
B中加入的试剂可能是,作用是 ___________;
E中加入的试剂可能是,作用是 ___________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________。
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________注入________中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。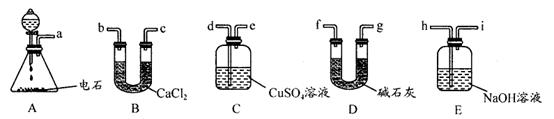
I.(1)A中制取乙炔的化学反应方程式为:。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用(填序号,下同)装置,
气体应从进;干燥乙炔最好选用装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验: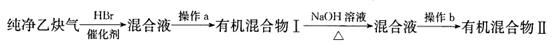
(1)操作b的名称是;
(2)有机混合物I可能含有的物质是(写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为;