一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝酸溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01mol·L-1的溶液 |
X |
Y |
Z |
W |
| pH |
12 |
2 |
8.5 |
4.5 |
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 ______________________________。

粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为_____________过滤、洗涤、干燥,操作II的名称是 。
(4)写出用SO2还原AuCl4一的离子方程式______________________。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法_____________________。
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用____________________________。
铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:___________________。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制得Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:______________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因:__________。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:_________________________。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和NaSO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示: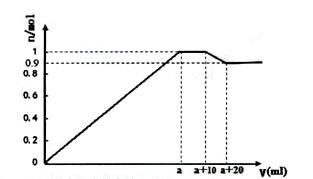
①写出(a+10)到(a+20)过程中反应的离子方程式:_____________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)=mol
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
| A.缩小容器容积 |
| B.及时分离出Y、Z |
| C.使用合理的催化剂 |
| D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义。
(1)二氧化氮与一定量空气混合通入水中能被水完全吸收,反应的化学方程式为_______________。若该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为___________。
(2)下列除去大气污染物的化学方程式不正确的是___________。
A.汽车尾气经催化剂作用:CO+NO NO2+C
NO2+C
B.石灰乳吸收硫酸厂尾气:SO2+Ca(OH)2=CaSO3+H2O
C.燃烧法除去尾气中硫化氢:2H2S+3O2 2SO2+2H2O
2SO2+2H2O
D.氨气与一氧化氮在一定条件下反应:4NH3+6NO 5N2+6H2O
5N2+6H2O
(3)大多数非金属氧化物能被氢氧化钠溶液吸收。例如,NaOH+SO2=NaHSO3,2NaOH+SO2=Na2SO3+H2O,
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,NO不溶于氢氧化钠溶液或水。
①同种反应物,其反应产物与浓度、温度、反应物相对量等因素有关。影响二氧化硫与氢氧化钠反应产物的因素与下列反应相同的是___________。
A.木炭与氧气反应
B.硫与氧气反应
C.钠与氧气
D.铜与硝酸溶液反应
②某NO与NO2混合气体通入氢氧化钠溶液被完全吸收,推测混合气体中气体组成为________。
A.  =1B.
=1B.  ≤1
≤1
C.  ≥1 D.无法判断
≥1 D.无法判断
某学习小组为探究胶体的性质进行如下实验:
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式是:____________,反应后得到的溶液呈________色。
(2)取少量上述溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为______________________。
(3)在小烧杯中加入20 mL 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈__________色,即制得Fe(OH)3胶体。
(4)取上步实验烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
①先出现红褐色沉淀,原因是________________________。
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:________________________。
③最后溶液颜色加深,原因是_____________________________。(用离子方程式表示)。
④用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象?________(写序号)。