我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
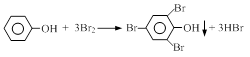
(1)请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.0 mL 0.01mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液8.50 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
(2)该废水中苯酚的含量为 mg/L。
(3)步骤2塞紧瓶塞的原因是 。
(4)步骤3若振荡时间过长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”,下同)。步骤4中若滴定至终点时滴定管尖嘴处出现气泡,而滴定前无气泡,会使测得的废水中苯酚的含量 。
(共12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”) 。
(6)写出NaOH溶液和盐酸反应表示中和热的热化学方程式 。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子官能团名称是_______________。
(2)试管A中加入几块碎瓷片的目的是___________。
(3)试管A中发生反应的化学方程式为 ___________,反应类型是_______。
(4)反应开始前,试管B中盛放的溶液是____________。作用是___________。
(5)可用_________的方法把制得的乙酸乙酯分离出来。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲装置中电解饱和食盐水的离子方程式 。
(2)为完成上述实验,正确的连接顺序为A连________;B连________(填写导管口字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为________________。
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是______________,对应的现象为_______。
乙装置烧杯中发生反应的离子方程式是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案所测结果更准确。
你认为不合理的方案的不足之处是_____________________。
②若按合理方案测定的数据计算,Cu的相对原子质量为 。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)环形玻璃搅拌棒能否用环形铁质搅拌棒代替 (填“能”或者“否”)其原因是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是___________。
A.200 mL B.400 mLC.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_____________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g。量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL/22400 mL·mol-1,依据的原理是________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将 (填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ;
② ;
③ 。