亚氯酸钠(NaClO2)是一种强氧化性漂白剂,常用于水的消毒杀菌和织物的漂白。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:

(1)反应I中的Na2SO3长期存放通常含有Na2SO4杂质,可用滴定法测定Na2SO3的纯度,向Na2SO3溶液中滴加酸性KMnO4溶液,判断滴定终点的现象为_______________。
(2)Ⅱ中反应的离子方程式是_____________________________________________。
(3)A的化学式是________________,装置Ⅲ中b在 极区产生。
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。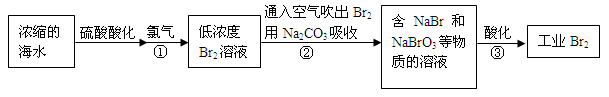
(1)NaBr的电子式是。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是。
(4)反应②的化学方程式是。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中(填字母)。
a.通入HBrb.加入NaBr溶液c.加入Na2CO3溶液d.加入Na2SO3溶液
硫化物在自然界中的部分循环关系如下。
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g) 2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol①
2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol①
S(s) + O2(g)  SO2(g)ΔH=-297.04 kJ/mol②
SO2(g)ΔH=-297.04 kJ/mol②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会(填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是。
④ 在上述反应的同时需要大量鼓入空气,其原因是。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程:。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操作 |
现象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
2SO2(g)+ O2(g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
| 温度/℃ |
400 |
500 |
600 |
| SO2转化率/% |
99.2 |
93.5 |
73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3•H2O)=" 2[c()+" c()+ c(H2SO3)]
b. c()+ c(H+)=" c()+" c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。 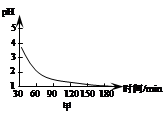

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
| 物理性质 |
熔点 |
沸点 |
升华 |
溶解性 |
| SeO2 |
340℃ |
684℃ |
315℃ |
易溶于水 |
| TeO2 |
733℃ |
1260℃ |
450℃ |
微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。