电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是 。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO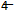 +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
在抗击非典型性肺炎期间,过乙酸(过氧乙酸)曾被广泛用做消毒剂。已知硫酸和过硫酸的结构简式如下: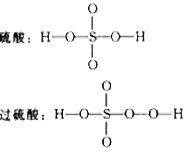
请从以下八个式子中选择答案回答下列问题(答案用编号表示):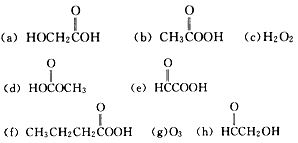
(1)过乙酸(过氧乙酸)的结构简式是______________。
(2)过乙酸的同分异构体是______________。
(3)过乙酸的同系物是_____________。
有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为 .有机物X的键线式为
.有机物X的键线式为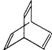
(1)有机物Y是X的同分异构体,且属于芳香烃,请写出Y的结构简式: 。
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,请写出其反应的化学方程式:____________。
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:
(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L,则残留的 Cr3+的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
甲醇被称为2l世纪的新型燃料。参考下列图表和有关要求回答问题:
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。上图是该过程中能量变化示意图,请写反应进程CH3OH(g)和H2O(g)反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) △H="c" kJ/mol
又知H2O(g) = H2O(l) △H="d" kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为 。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________(填“增大”、“减小”、“不变”)。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为 。电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______________mol。
③用平衡移动原理解释图中电解池中阴极区pH增大的原因:
I.(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,
每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①该反应的平衡常数K的值为 ;
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
③计算②中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
II. 在0.5 L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g) 2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
④比较K1,K2的大小,K1_________K2(填写“ >”、“=”或“<”)。
⑤在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1 mol、2 mol时,则该反应的V(H2)正_________ V (H2)逆(填写“>”、“=”或“<”)。