用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是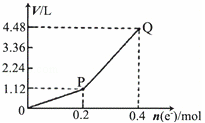
| A.电解过程中,溶液的H+浓度不断减小 |
| B.当转移0.4mol e﹣时,电解生成的铜为6.4g |
| C.阳极电极反应式为2H2O+4e﹣=4H++O2↑ |
| D.Q点对应的气体中,H2与O2的体积比为2:1 |
对于N2(g)+3H2(g)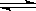 2NH3(g),不能作为反应达到平衡状态的判断依据是
2NH3(g),不能作为反应达到平衡状态的判断依据是
| A.恒容密闭容器中总压强不变 |
| B.恒容密闭容器中混合气体的密度不变 |
| C.生成氨气的速率与氨气分解的速率相等 |
| D.N2、H2、NH3的浓度不再发生变化 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为571.6 kJ |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.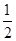 H2SO4(aq)+ H2SO4(aq)+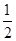 Ba(OH)2(aq)= Ba(OH)2(aq)=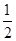 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
反应4NH3+5O2 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
| A.v(O2)=0.0125 mol·(L·s)-1 |
| B.v(NO)=0.01mol·(L·s)-1 |
| C.v(H2O)=0.12 mol·(L·s)-1 |
| D.v(NH3)=0.1 mol·(L·s)-1 |
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是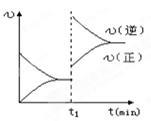
A.2SO2(g)+O2(g)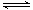 2SO3(g);△H<0 2SO3(g);△H<0 |
B.4NH3(g)+5O2(g)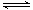 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
C.H2(g)+I2(g)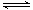 2HI(g);△H>0 2HI(g);△H>0 |
D.N2(g) +3H2(g) 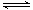 2 NH3(g) △H<0 2 NH3(g) △H<0 |