下列说法正确的是
| A.CO、SO2均属酸性氧化物 |
| B.凡能电离出H+的化合物均属于酸 |
| C.碱性氧化物一定是金属氧化物 |
| D.电解质一定是化合物,非电解质可以是单质也可以是混合物 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度: c(Na+)>c(HC )>c(
)>c( )>c(H2CO3)>c(OH-)>c(H+)
)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c( )+3c(HC
)+3c(HC )+3c(H2CO3)
)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g)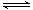 B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,下列结论正确的是
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2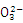 +4H+ +4H+ S S + 3S↓+ 2H2O + 3S↓+ 2H2O |
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)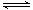 TiO2·xH2O↓+4HCl TiO2·xH2O↓+4HCl |
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 C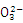 、 K+、 Al 、 K+、 Al |
| D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有N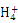 |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在S |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
常温下(I)100mL0.1 mol/L的NaA溶液中的离子总物质的量为X,(Ⅱ)100 mL 0.1 mol/L的NaB溶液中的离子总物质的量为Y。下列推断正确的是
| A.若X>Y,则酸性:HA>HB |
| B.若X=Y,则HB一定是强酸 |
| C.若酸性:HA<HB,则X和Y关系不确定 |
| D.若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |