焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
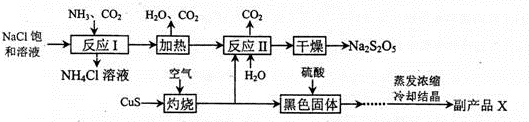
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子____ mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为_______________。
(4)副产品X的化学式是 ________________,在上述流程中可循环使用的物质是___________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂________________。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠
④酸性高锰酸钾 ⑤稀硫酸
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示: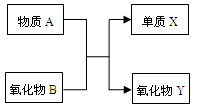
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为;请写出质量数为26的A的一种核素符号。
(2)若A为非金属单质,B为非金属氧化物,且A、X为同主族元素,则该反应的化学方程式为。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是NA。
现有A、B、C、D四种元素,它们的质子数依次增多。①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;③C+离子比B3+离子多8个电子;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C.D 的名称:C:;D:
(2)A在周期表中的位置。
(3)写出B2A3与氢氧化钠溶液反应的离子方程式。
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):离子半径:。
写出下列物质的电离方程式:
H2SO4
Ba(OH)2
Na2SO4
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取 |
| B.升华 |
| C.结晶 |
| D.分液 |
E.蒸馏
F.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。