二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
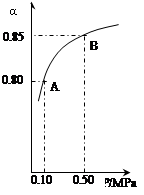
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中,放出的热量为______kJ。
按以下装置图进行实验,填写有关现象及化学方程式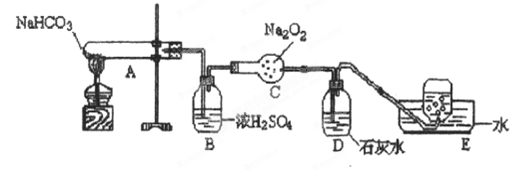
①A中现象是____________________
②B中浓硫酸的作用是____________________
③C中发生反应的化学方程式为____________________
④D中现象是____________________,反应的化学方程式是______________
⑤E中收集的气体是____________________
完成下列化学方程式并改写成离子方程式:(每题3分)
(1) AgNO3 + BaCl2:
(2) Na2CO3 + Ca(OH)2:
写出下列物质的电离方程式:(每题2分)
(1) Na2SO4:
(2) Ba(OH)2:
维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有________(填“氧化性”或“还原性)
将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有和(写化学式)。
(2)完全反应后,所得溶液中的溶质是。
(3)写出反应过程其中1个化学反应的化学方程式:。
(4)整个反应过程中,被还原的HNO3总的物质的量是mol。