下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。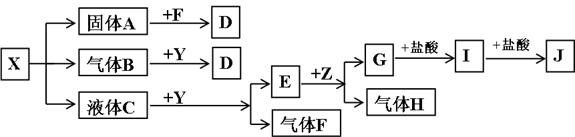
请回答下列问题:
(1)Y的电子式 。关于Y的说法正确的是 。
A.Y是酸性氧化物 B. Y是过氧化物 C. Y是碱性氧化物 D. Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)写出G与盐酸反应生成I的离子方程式 。
(4)写出B与Y反应的化学方程式 。
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中转移电子的物质的量是 mol,该反应总反应的化学方程式为
。
(15分)
近期研究证实,中药甘草中的异甘草素在药理实验中显示明显的促进癌细胞凋亡和抑制肿瘤细胞增殖的活性,且对正常细胞的毒性低于癌细胞。异甘草素可以由有机物A和有机物B合成(A、B均为芳香族含氧衍生物),且由A和B合成异甘草素要用到以下反应:
请回答下列问题:
⑴有机物B分子式为C7H6O2,A和B均能与浓溴水反应生成沉淀。A和B具有一种相同的含氧官能团,其名称为;B的核磁共振氢谱有四个峰,峰面积之比是2:2:1:1。以下说法正确的是(填序号)。
①有机物B能发生很多类型的反应,例如:中和、取代、氧化、还原、加成反应
②与B互为同分异构体的芳香族含氧衍生物共有两种(不含B)
③B能与碳酸氢钠溶液反应放出二氧化碳气体
⑵质谱表明有机物A相对分子质量为152,其碳、氢、氧元素的质量分数比为12:1:6。有机物A的分子式为;已知A分子中的官能团均处于间位,写出A、合成异甘草素的化学方程式。
⑶初步合成的异甘草素需要经过以下处理工艺;
I加入一定量的水,再加入一定量的乙醚提取2次 II用无水MgSO4干燥、过滤减压蒸出。 III洗涤、浓缩得黄色粉末,再用含水乙醇处理得黄色针状晶体。
步骤II蒸出的物质可能是。以上处理工艺中涉及的分离提纯操作依次有。
⑷有机物D符合下列条件,写出D的结构简式。
①与A互为同分异构体,且能发生水解反应②1molD能与3moNaOH反应
③苯环上的氢被氯取代的一氯代物有两种
⑸有机物B还可以发生以下变化: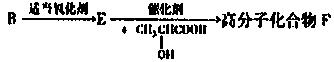
已知:F的单体是由E和CH3CHCOOH按1:1生成,请写出E→高分子化合物F的化学方程式。
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是。在A、B、C这三种分子中,属于非极性分子的有(写化学式)。
⑵下列有关B的说法中正确的是。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是,其中心原子轨道的杂化类型是。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。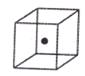
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.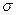 键 h.
键 h.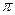 键
键
(15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。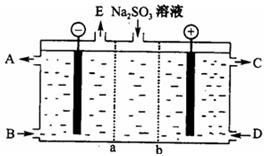
①图中a表示离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示,E表示。
②阳极的电极反应式为。
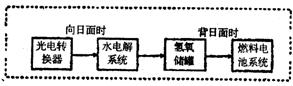
I.我国即将建成自己的载人空间站。载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。
⑴某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的某极反应为:4OH--4e-=O2↑+2H2O,则另一极反应为:。
⑵有人提出,可以设计某温度下的反应:2CO=2C+O2(△H>O、△S<O)来消除CO的污染。请你判断该温度下上述反应是否能发生并说明理由是。
Ⅱ.大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
⑴有关大气固氮(以N2+O2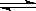 2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2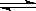 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数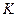 的值如下表。
的值如下表。
| 反应 |
N2+02 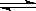 2NO 2NO |
N2+3H2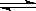 2NH3 2NH3 |
||
| 温度/℃ |
27 |
2000 |
100 |
400 |
| K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
⑵已知:N2(g)+3H2(g) 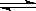 2NH3(g)
2NH3(g)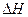 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)="2H20(1)" 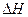 ="-571.6" kJ·mol-1
="-571.6" kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的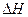 =KJ·mol-1。
=KJ·mol-1。
⑶某研究小组在673 K、30 MPa下,在体积为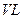 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g) 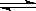 2NH3(g),其
2NH3(g),其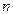 (H2)和
(H2)和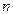 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。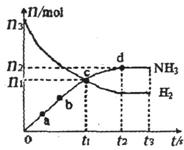
①下列叙述正确的是。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则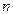 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)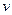 (H2)=。
(H2)=。
③若开始时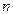 (N2)=
(N2)=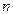 (H2),则反应的平衡常数
(H2),则反应的平衡常数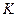 =(用代数式表示)。
=(用代数式表示)。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下: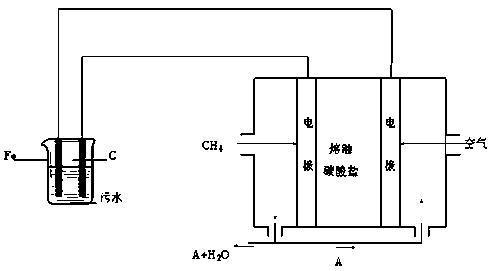
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是①;
②4OH- - 4 e-= 2H2O +O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。