(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成的NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。

T=a℃ V=2L T=a℃ V=2L 移动活塞
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2 mol NH3的同时消耗1 mol N2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (用初始压强P0表示)。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图所示。
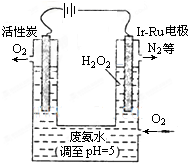
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为 。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)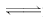 CH3OH(g).
CH3OH(g).
根据题意和所给图象完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,
(2)升高温度,K值(填“增大”“减小”或“不变”).
在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
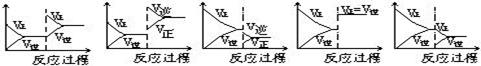
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是(4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为反应。
在密闭容器中进行可逆反应: CO(气)+NO2(气)  CO2(气)+NO(气) △H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(气)+NO(气) △H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通人CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总 数
数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图所示
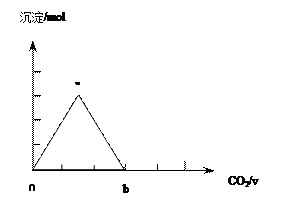
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系; 并写出与上图中不同曲线处对应的离子反应方程式 ;
并写出与上图中不同曲线处对应的离子反应方程式 ;
。