研究化肥的合成、废水的处理等有现实的重要意义。
(1)工业生产中,以NH3为原料制硝酸,写出工业生产硝酸最后一步的化学方程式 。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
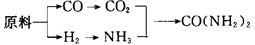
已知:CO+H2O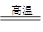 CO2+H2;
CO2+H2;
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。现有甲、乙、丙三家工厂生产原料如下:
甲厂以焦炭和水为原料;
乙厂以天然气和水为原料;
丙厂以石脑油(主要成分为C5H12)和水为原料。
请根据上述信息判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高:________(填“甲”、“乙”或“丙”)。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。
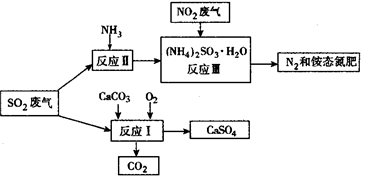
①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的铵态氮肥中SO42-所用试剂是_______________________。
(4)为减少环境污染,工业上也常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A , C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:。
(3)写出A、B两元素的最高价氧化 物的水化物之间的相互反应的化学方程式:。
物的水化物之间的相互反应的化学方程式:。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
由铜、锌和稀硫酸组成的原电 池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从
池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从 极到极。
极到极。
下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧 剧烈______________
剧烈______________
(2) MnO2加入双氧水中反应更剧烈______________
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完___________
(4) 镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生________
根据下列叙述,画出对应1--3的微粒结 构示意图:
构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍:。
(2)与Ar原子电子层结构相同的-1价阴离子:。
(3)质量数为23,中子数为12的原子。
(4)写出下列物质的名称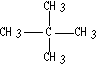 ___________
___________
(5)C5H12的同分异构体有种
(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的化学式是;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是;