钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号).
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
、.
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会(填“偏高”、“偏低”或“无影响”).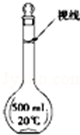
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会;加蒸馏水时不慎超过了刻度,会.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会.
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应.
4分)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为,可知所配成的盐酸溶液的物质的量浓度为.
从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是mol/L,含NaOH的质量g.
4.8gO2和0.2molCO2,质量之比是,在同温同压下的体积之比是.相同物质的量的SO2和SO3,所含分子的数目之比为,所含O原子的物质的量之比为.
选择下列实验方法分离物质,将分离方法的序号填在横线上.
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
(1)分离饱和食盐水与沙子的混合物.
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾.
(3)分离水和汽油的混合物.
(4)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物.
(5)从碘的水溶液里提取碘.