化学方程式可简明地体现元素及其化合物的性质。已知氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO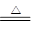 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4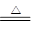 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是( )
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是
| A.16 | B.32 | C.64 | D.128 |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从小到大的是
| A.p (Ne) < p (H2) < p (O2) | B.p (O2) < p (Ne) < p (H2) |
| C.p (H2) < p (O2) < p (Ne) | D.p (H2) < p (Ne) < p (O2) |
下列物质中含氢原子数最多的是
| A.2 mol CH4 | B.3 mol NH3 | C.4 mol H3PO4 | D.5 mol H2 |
下列数量的各物质:① 0.5mol NH3,② 标准状况下22.4L He,③ 4℃时9ml H2O,④ 0.2mol H3PO4中,所含原子个数由大到小的顺序是
| A.②③④① | B.④③②① | C.①④③② | D.①④②③ |
对于等质量的SO2和SO3来说,下列关系中正确的是
| A.含氧原子的个数比为2:3 | B.含硫元素的质量比为5:4 |
| C.含氧元素的质量比为6:5 | D.含硫原子的个数比为1:1 |