(1)下列实验操作或叙述正确的是_______(填字母)
A.向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊
B.用金属钠检验无水乙醇中含有的少量水
C.除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷
D.向苯酚浓溶液中滴入少量浓溴水可观察到白色的三溴苯酚沉淀
E.用氨水洗去试管内壁的银镜
F.证明氯乙烷分子中含有氯原子,可将氯乙烷溶于AgNO3的HNO3溶液中
G.乙醇与氢溴酸的反应中断裂了O-H 键
H.甲醛与苯酚制取酚醛树脂的反应属于聚合反应
I.在蔗糖的水解液中加新制Cu(OH)2悬浊液,有砖红色沉淀生成
(2)化合物A(C4H8Br2)可由下列反应制得,C4H10O  C4H8
C4H8  C4H8Br2,则结构式不可能的是( )
C4H8Br2,则结构式不可能的是( )
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2 C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
(3)写出下列反应的化学方程式
①第(1)题A选项:向饱和苯酚钠溶液中,不断通入足量二氧化碳气体________________________;
②乙醛与银氨溶液反应_________________________________。
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: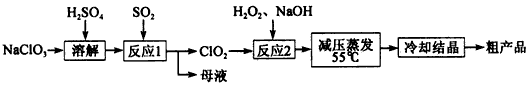
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有(不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为

d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶(结构如下图)。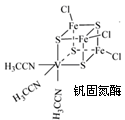
①V2+基态时核外电子排布式为。
②钒固氮酶钒的配位原子有(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如下图所示,该晶胞中含有钒原子数目为。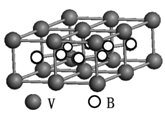
(3)烟酰胺(结构式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有,1mol该分子中含σ键数目为。 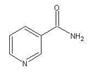
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s)△H3
则△H3 =kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;电解熔融氯化镁,阴极的电极反应式为。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为。
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为。
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图:
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为; B的结构简式为。
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是。
(4)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。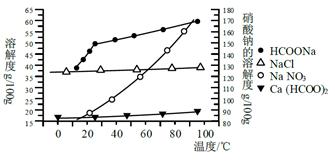
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属 离子 |
开始沉淀 的pH |
沉淀完全 的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2.。
步骤3.。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、、洗涤、60℃时干燥得甲酸钙晶体。
化合物A(分子式为:C6H6O2)是一种有机化工原料,在空气中易被氧化。由A 合成黄樟油(E)和香料F的合成路线如下(部分反应条件已略去):
(1)写出E中含氧官能团的名称:和。
(2)写出反应C→D的反应类型:。
(3)写出反应A→B的化学方程式:。
(4)某芳香化合物是D的同分异构体,且分子中只有两种不同化学环境的氢。写出该芳香化合物的结构简式:(任写一种)。
(5)根据已有知识并结合流程中相关信息,写出以 、
、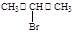 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br  CH2=CH2
CH2=CH2