溶液、胶体和浊液这三种分散系的本质区别是
| A.是否有丁达尔现象 |
| B.是否能通过滤纸 |
| C.分散质粒子的大小不同 |
| D.是否均一、透明、稳定 |
 下列叙述正确的是()
下列叙述正确的是()
| A.0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
可逆反应mA(固)+nB(气)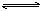 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如右下图,下列叙述正确的是()
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如右下图,下列叙述正确的是()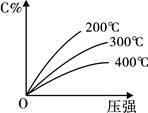
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡右移 |
| C.达平衡后,增加A的量有利于平衡向右移动 |
| D.化学方程式中n>e+f |
下列说法正确的是( )
| A.电离平衡常数受溶液浓度的影响 |
| B.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大 |
| C.电离平衡常数可以表示弱电解质的相对强弱 |
| D.H2CO3的电离常数表达式:K= |
下列关于电解质溶液的正确判断是 ( )
A.由0.1mol/l一元碱HA溶液的pH=3, 可推知NaA溶液存在A- + H2O HA + OH- HA + OH- |
B.在pH=0的溶液中,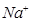 、 、 、 、 、 、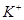 可以大量共存 可以大量共存 |
C.由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=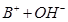 |
D.在pH = 12的溶液中,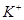 、 、 、 、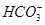 、 、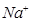 可以大量共存 可以大量共存 |
下列表述正确的是()
A.碳酸氢钠溶液的水解反应: |
B.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2 2OH-+H2↑+Cl2 |
| C.氢硫酸的电离方程式:H2S=2H++S2- |
| D.向氢氧化镁饱和溶液中滴加氯化铁溶液,出现红褐色沉淀 |