在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
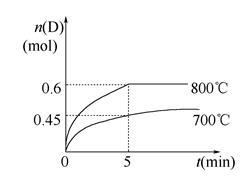
请回答下列问题:
(1) 700℃时,0~5min内,以B表示的平均反应速率为___________。
(2) 能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3) 若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
现有下列十种物质:① O2 ② Fe ③ CaO ④CO2⑤ H2SO4 ⑥ Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧硫酸钠溶液 ⑨稀硝酸 ⑩Cu2(OH)2CO3.
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 |
 |
氧化物 |
胶体 |
|
| 属于该类的物质 |
② |
⑧ ⑨ |
(2)上述物质属于非电解质的有;上述物质能与盐酸反应的电解质有(填序号)。
(3)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学反应方程式为__ ________________________________________________________。
(4) 过量的②与⑨发生化学反应的化学方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,该反应的还原剂是(填化学式),当生成0.05mol的NO气体时,转移的电子的物质的量为__________。
填空:
(1)实验室用钠和硫酸铜溶液反应,有关反应的化学方程式有:
_______________________________,________________________________________;
(2)表面附有氧化膜(成分是MgO)的镁条放入稀硫酸中,开始反应时的离子方程式是:________________________________________________________________________;
反应片刻后,可观察到有气体产生,其离子方程式是:
________________________________________________________________________。
(3)用小苏打片(NaHCO3)治疗胃酸(0.2%~0.4%的盐酸)过多的化学方程式为:
________________________________________________________________________。
(4)看图回答下列问题:
上图中不会产生气体的是 (填编号),写出D中发生反应的化学方程式:
。
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为;
②若反应温度不变,反应物的起始浓度分别为:c(M)="4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①H2SO4溶液: HSO4-  H++SO42- H++SO42- |
②NaHSO4溶液: HSO4-  H++SO42- H++SO42- |
③盐酸 HCl=H++Cl |
| 10% |
29% |
100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________。
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
(1) 0~8 min,v(CO)=__________mol·L-1·min-1。
(2) 测得在不同温度下,K值如下:
| 温度(℃) |
500 |
700 |
| 平衡常数K |
2.00 |
2.50 |
①若500℃时进行反应,CO2起始浓度为3 mol·L-1,CO的平衡浓度为________。
②反应中的a________0(填“大于、小于、等于”)。
③下列措施中,能使平衡时c(CO)/c(CO2)的比值的增大的是________(填序号)。
A.升高温度 B.再加入一些铁粉 C.增大压强 D.充入一定量氮气
④在700℃时的某时刻测得CO2浓度为1.4mol·L-1,CO浓度为2.0mol·L-1,反应向方向进行(填“正反应”或”逆反应”),理由是:。
已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较ab(填“>、=、<”)
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。若将反应容器的体积压缩,平衡向方向移动(填“正反应”或”逆反应”),该反应的平衡常数将 。(填“增大”“减小”或“不变”)
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达平衡后,吸收热量ckJ,C3的浓度也是w mol/L,则c 等于 (用a、b表示)。
(4)能说明该反应已经达到平衡状态的是
A 2v逆(A2)=v正(B2) B v正(C3)=2v正(B2)
CA2与C3浓度相等 D.混合气体的平均相对分子质量不变
E.容器内压强保持不变 F.容器内密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体B.适当升高温度
C.增大B2的浓度D.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A2和1molB2,500 ℃时充分反应达平衡后,放出热量dkJ,则db(填“>、=、<”)
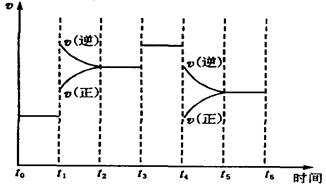
(7)下图表示此反应的反应速率v和时间t的关系图。
根据下图判断,在t1和t4时刻改变的外界条件分别是和 。