某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
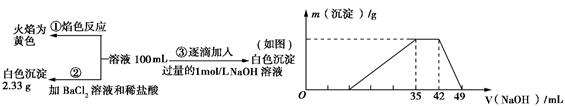
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有: 。
(2)写出实验③图像中沉淀溶解阶段发生的离子反应方程式:________________________
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为 。NO是否存在? 填(“存在”“不存在”或“不确定”)。
有A、B、C、D、E、F六种短周期元素,它们的核电荷数按C、F、A、B、D、E的顺序增大。已知E、F位于同一主族;C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物;CB是一种10e- 的气态分子;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B,E ,F;
(2)写出E在元素周期表中的位置第周期第族;
(3)写出D2A2的电子式;EB4
(4)用电子式表示FA2的形成过程;
(5)比较元素E和F的非金属性强弱,E的非金属性于F(填“强”或“弱”),并用化学方程式证明上述结论;
(6)以上A、B、C、D中某些元素可形成的既含离子键又含非极性共价键的化合物是;既含离子键又含极性共价键的化合物是。(写化学式)
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3的ΔH=—99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示___________、___________;
(2)图中△H=___________KJ·mol-1;
(3)已知单质硫的燃烧热为296KJ·mol-1,写出表示硫燃烧的热化学方程式___________;
(4)计算由S(s)生成3molSO3(g)的△H=___________。
下图为某同学设计的一个原电池。
若电解质溶液为H2SO4:
①Fe是______极,其电极反应为_________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu是______极,其电极反应为___________________,该电极上反应现象是________________;
若电解质溶液为CuSO4:
③Cu电极上电极反应为________________,其反应现象是________________。
依据叙述,写出下列反应的热化学方程式。
①在25℃、101 kPa下,32g甲醇(CH3OH)的燃烧放出的热量为725.8kJ,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)
______________________________________________________________
②1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反
应,放出114.6 kJ热量,表示其中和热的热化学方程式为
_________________________________________________________________。
元素周期表有________个横行,叫周期,每一周期中元素原子的 ________相同,从左到右元素的金属性依次________(填增强或减弱);元素周期表中有________个纵行,第ⅥA族处在第________纵行,同一主族从上到下,元素的非金属性依次________(填增强或减弱)。