实验室欲配制6.0mol/L的H2SO4溶液,现有三种不同浓度的硫酸:
①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的浓硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.配制要求:①②两种硫酸全部用完,不足的部分由③来补充.
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________mol/L(保留1位小数).
(2)配制时的操作如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸________mL,沿玻璃棒缓缓倒入上述混合液中,并不断搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入________mL容量瓶中;
D._________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1cm~2cm处,改用胶头滴管滴加,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(3)容量瓶使用前需________,瓶上标有________、________、________
(4)进行操作C前还需注意__________________,否则会使所配溶液的浓度_______(填“偏大”、“偏小”或“无影响”).
动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:①,试管,烧杯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
写出下列实验步骤所对应的化学方程式
②,③,
(4)实验结论:同周期元素从左往右失电子能力逐渐减弱,得电子能力逐渐增强
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
(1)A中的化学反应方程式:。
(2)A装置还可用于制取气体(只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物)
B.NaOH 固体
C.硫酸溶液
D.石灰石(含CaCO3)
下图中的几种仪器装置都可以制得氢气,其中: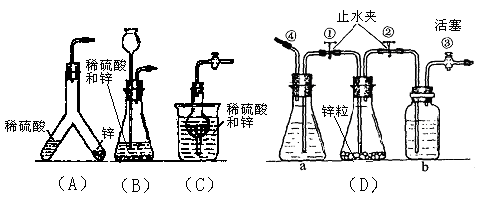
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号),能够灌充升空的小氢气球的装置是。
(2)在(D)装置中a中的液体应是;b中的液体应是,其作用是。
(3)使(D)装置发生氢气的操作顺序应该是。
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现甲同学的实验中,褪色的溶液里有少许的淡黄色浑浊,推测在制得的乙炔中可能还含有少量的还原性杂质气体,由此他提出必须先将其除去,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式__________________.
(2)甲同学设计的实验________。(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。(多选扣分).
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔 D.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有一种杂质气体是________,它与溴水反应的化学方程式________________;验证过程中必须全部除去。
(4)如果选用下列编号为A、B、C、D的四种装置(可以重复使用)来实现乙同学的实验方案。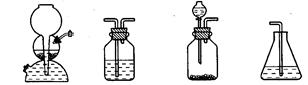
A B C D
请你写出所选择的装置编号及装置中的化学药品名称填在方格内或括号内
(电石、水)( ) ( )( )
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是_________________。
(2)方案二:按下图装置进行实验。并回答以下问题: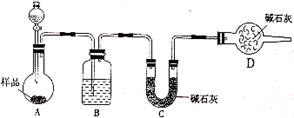
①分液漏斗中应该装___________(填“盐酸”或“稀硫酸”),D装置的作用是_________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_____________;
②若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥后的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(保留一位小数)。