向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图,试回答: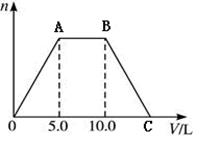
(1)AB段表示的离子方程式是:_________________________
(2)整个反应过后溶液的导电能力较反应前________________(强、弱、基本不变)
(3)C点时通入V(CO2)为___________L
(4)混合溶液中NaOH和Ca(OH)2的物质的量之比为__________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。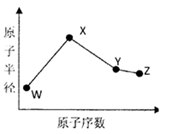
(1)Y在周期表中的位置是。
(2)用电子式表示化合物X3W的结构 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则ab(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是。
(6)已知W的单质与气体B在一定条件下可形成气体A,即: △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
①0min~10min,W2的平均反应速率。
②反应在第l0min改变了反应条件,改变的条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是。
a.更新了催化剂 b.升高温度c.增大压强 d.减小A的浓度
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得: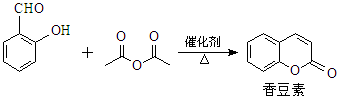
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有2个羟基通常不稳定,易脱水形成醛基。
请回答下列问题:
(1)香豆素的分子式为;
(2)由甲苯生成A的反应类型为;A的化学名称为。
(3)由B生成C的化学反应方程式为;
(4)B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中只出现四组峰的有种;
(5)D的同分异构体中含有苯环的还有种,其中:
①既能发生银境反应,又能发生水解反应的是(写结构简式)。
②能够与饱和碳酸氢钠溶液反应放出CO2的是(写结构简式)。
选做
(1)写出有机物的系统命名: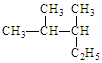 。
。
(2)键线式 表示的分子式为;名称是。
表示的分子式为;名称是。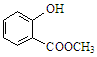 中含有的官能团的名称为。
中含有的官能团的名称为。
(3)丁基的4个结构简式为_______________________。
(1)可正确表示原子轨道的是:。
| A.2s | B.2d | C.3p | D.3f |
(2)镓(Ga)原子序数为,写出其基态原子的电子排布式:。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是。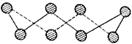
(4)用“>” “< ” “=” 填空:
第一电离能的大小:MgAl;熔点的高低:KClMgO。
(5)NO3-的空间构型为(用文字描述)。
(6)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是。CO与N2结构相似,CO分子内σ键与π键个数之比为。
选做
(1)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A________;B__________;C________;D__________。
(2)单质硼有无定形和晶体两种,参考下表数据,回答问题。
| 金刚石 |
晶体硅 |
晶体硼 |
|
| 熔点/K |
>3 823 |
1 683 |
2 573 |
| 沸点/K |
5 100 |
2 628 |
2 823 |
| 硬度/Moh |
10 |
7.0 |
9.5 |
①晶体硼的晶体类型是____________,理由是。
②已知晶体的基本结构单元都是由硼原子组成的正二十面体,其中含20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察下图,回答:这个基本结构单元由个硼原子组成,其中B—B键的键角是_______,共含有个B—B键。