(1)1.5mol 的H3PO4含有 个H3PO4分子;
(2)同温、同压下等质量的SO2和NO2,它们所占的体积比为 ,所含氧元素的物质的量之比为______________________;
(3)2 mol O2与1 mol O3的摩尔质量的比是______________。
(4)某化合物的相对分子质量为m,在t ℃ 时A ml该化合物饱和溶液为B g,将其蒸干后得到固体C g。
该化合物在t ℃ 时的溶解度为 g,该饱和溶液中溶质的物质的量浓度为 。
C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g)△H="-196.6" kJ·mol-l
2 SO3(g)△H="-196.6" kJ·mol-l
2 NO(g) +O2(g)  2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g)  SO3(g)+NO(g)的△H= kJ·mol-l
SO3(g)+NO(g)的△H= kJ·mol-l
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)  CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为 ;Pl P2(填“>、<或=”);平衡常数KM=__________。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是________。
Ni( OH)2 +M。下列有关说法不正确的是________。
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
Ⅰ、已知在常温常压下:①H2O(I)=H2O(g) △H=" +44.0" kJ.mol-1
②2CH3OH(I)十3O2(g)=2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ、工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化及甲醇的物质的量随时间、温度变化如下图所示。(T1、T2均大于300℃)
(1) 则上述CO2转化为甲醇的反应的△H1___ _0(填“>”“<”或“=”)。
(2)从反应开始到平衡(10min),用H2表示 的反应速率为__________;
(3)下列说法正确的是 。
A.若保持恒温,当容器中n(CH 3OH)︰n(H2O)为1︰1时,该反应已达平衡状态
B.若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态
C.若其他条件不变,则平衡常数:K(T1)<K (T2)
D.处于A点的反应体系的温度从T1变到T2,达到平衡时 增大
增大
(4)对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 。
A.增加CO2的量 B.升高温度
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
(5)某温度下,将4mol CO和12mol H2,充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO) ="0.5" mol·L—1,,则该温度下该反应的平衡常数为 。
(6)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为A,则容器内的压强与起始压强之比为_____ ___。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:  ; KI+I2
; KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、 Fe3+),用适量蒸 馏水溶解,并加稀盐酸酸化,将所得溶液分为2份。
第一份试液中滴加 KSCN溶液后显红色;
第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;
①加KSCN溶液显红色,写出生成红色物质的离子方程式是 ;CCl4中显紫红色的物质是___________________(用电子式表示)(1分)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:
IO3-+5I-+6H+==3I2+3H2O和 _______ ______。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:______ ________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
弱电解质的电离平衡、盐类的水解平衡和难溶电解质的溶解平衡均属于化学学习中的动态平衡。已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
(1)Na2A溶液显碱性的原因 (用离子方程式回答);
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 。
A.c(H+)·c(OH-)=1×10―14B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
Ca2+(aq)+A2-(aq) △H>0。 Ksp=C(Ca2+)·C(A2—)
①降低温度时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,C(Ca2+) ,原因是 ;
(4)CaCO3是一种难溶物质,其Ksp=2.8×10—9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
[化学——选修3:物质结构与性质]
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)+3价Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
(2)CaO晶胞如图所示,与每一个钙离子距离最近并且距离相等的钙离子有_________个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3401 kJ/mol、NaCl:786 kJ/mol。 导致两者晶格能差异的主要原因__________________。
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键类型是__________,则形成的化学键类型是 。
(4)从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周 期VIB族。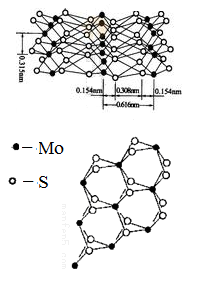
①下列说法正确的是__________
| A.晶体硅中硅原子的轨道杂化类型为sp2 |
| B.电负性:C<S |
| C.晶体硅和C60比较,熔点较高的是C60 |
| D.Mo元素基态原子的价电子排布式为4d55s1 |
E.MoS2的晶体中每个Mo原子周围距离最近的S原子数目为4
F.MoS2的晶体中Mo-S之间的化学键为极性键、配位键、范德华力
②根据MoS2的晶体结构回答:MoS2纳米粒子具有优异的润滑性能,其原因是_____________ .