实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |

完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_ 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=___ [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将___ _(填“偏大”、“偏小”、“不变”)。如改用60 mL0.5 mol/L的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,
则连接后的装置叫。
电极反应式:锌板: _______________;
铜板: ___________
(2)在B图中,(a和b均为惰性电极)
使a极析出铜,请加以必要的连接后,该装置叫。
电极反应式,a极:;b极: 。
在经过一段时间后,停止反应并搅均溶液,溶液的pH(升高、降低、不变),加入一定量的 后,溶液能恢复至与电解前完全一致。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: 回答下列问题:
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如右下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:电解的离子方程式(总反应)为。
(4)下列实验操作中必要的是(填写字母)。
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→
再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计
算式表示)。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体。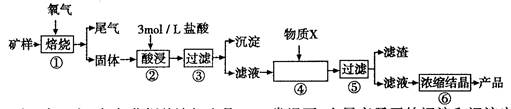
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 |
开始形成氢氧化物沉淀的pH |
完全形成氢氧化物沉淀的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、下图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式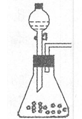
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是____(填字母);若选用甲装置,则烧杯中的下层液体可以是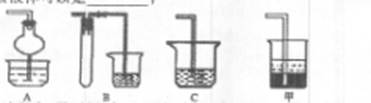
(3)步骤②酸浸过程中,需要用到3 mollL的盐酸l00mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有____;
(4)步骤④加入物质X的目的是,物质X可以选用下列物质中的;
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行次过滤操作。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则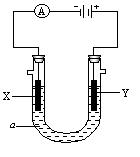
①电解池中X极上的电极反应式是。
在X极附近观察到的现象是。
②Y电极上的电极反应式是,
检验该电极反应产物的方法是。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是
②Y电极的材料是,电极反应式是
(说明:杂质发生的电极反应不必写出)