利用下图装置测定中和热的实验步骤如下:
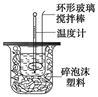
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_________ __________________。
(2)倒入NaOH溶液的正确操作是:____________。 (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1) /℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH =__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.02 mol CaC2的电石和1.60 g含杂质18.7 %的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题。
(1)所用装置的连接顺序是 (填各接口的字母)。
(2)写出A、C中所发生的两个反应的化学方程式(有机物写结构简式):
A
C
(3)为减慢A中的反应速率,X应选用__________________。
(4)F中留下的气体除含少许空气外,还有______________________。
(5)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为___________。
I、右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)含有一个甲基和一个乙基的M的同分异构体有 种。
Ⅱ、利用右图装置还可以验证醋酸、苯酚、碳酸的酸性强弱。
(4)A中固体试剂是 (选填字母);
a.醋酸钠 b.碳酸氢钠 c.苯酚钠
(5)C中反应的化学方程式是: ;
(6)有同学认为没有B装置,也可以验证酸性的强弱,
这种认为是不合理的,原因是 。
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
现用该浓硫酸配制980 mL 0.1 mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称);
(2)配制0.1mol/L的稀硫酸980mL需用量筒量取上述浓硫酸体积为 mL。
(3)实验中两次用到玻璃棒,其作用分别是: 、 。
(4)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为 。(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高有 (填序号)。
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
某同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)知识储备:将氯气通入水中的化学方程式为 ;
(2)探究“溶液的红色突然消失”的原因:
①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是 。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为 ,则证明“猜想a”正确;若现象为 ,则证明“猜想b”正确。
某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。