某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后放入试管中,加入少量水后加热至水沸腾;再向溶液中滴加无色的酚酞溶液 |
A浮在水面 上熔成小球四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 上熔成小球四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞的冷水中 |
C剧烈反应迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 |
D反应不十分剧烈产生无色气体 |
| ⑤将铝条投入稀盐酸中 |
E生成白色胶状沉淀继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀。 |
请你帮助该同学整理并完成实验报告。(每空1分)
1.实验内容:填写与实验步骤对应的实验现象的编号和③的化学方程式
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
|
|
|
|
|
|
实验③ ;
2. 实 验结论: 。
验结论: 。
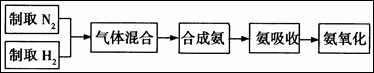
合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是 ,其中发生的化学反应方程式为 ;
(3)设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因是 ;
(4)设备C的作用是 ;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中的c(H2O):c(CO)不低于 。
甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)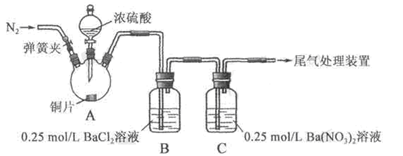
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 |
___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:__________。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_______________。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。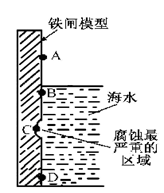
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
NH3经一系列反应可以得到HNO3,如下图所示。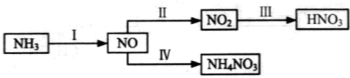
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2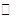 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。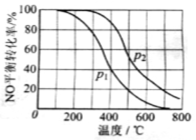
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)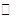 N2O4(g)△H1
N2O4(g)△H1
2NO2(g)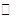 N2O4(l)△H2
N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。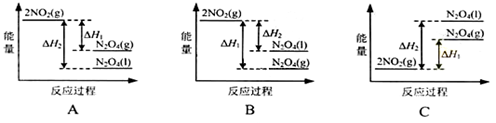
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。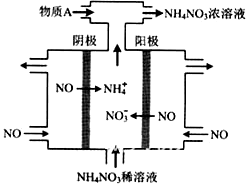
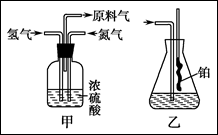
实验室模拟合成氨和氨催化氧化的流程如下:


已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从上图中选择制取气体的合适装置:
氮气 、氢气 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (填“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式: 。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: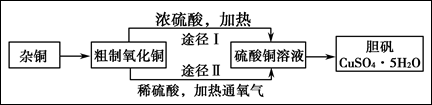
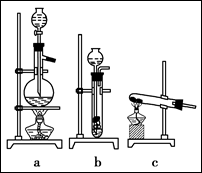
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
A.蒸发皿
B.石棉网
C.泥三角
D.表面皿
E.坩埚钳
F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化