(14分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.4 mol/L的醋酸溶液,用0.4 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
⑴配制250 mL 0.4 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
⑵为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_____________________________________________________________________
_____________________________________________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案________________________
______________________________________________________________________。
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈___________色,具有________光泽,但断面很快变_________,主要是由于生成一薄层________________。若把钠水中,其反应的化学方程式为_____________________________。
(8分)有一包白色粉末,其中可能含有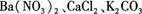 ,现做以下实验。
,现做以下实验。
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入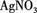 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据上述实验现象,判断白色粉末中一定含有 (填化学式),可能含自(填化学式)。写出(3)中有关反应的离子方程式。
实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
⑴.配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
⑵.用托盘天平称取氯化钠固体,其质量为__________ g。
⑶.下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
⑷.如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
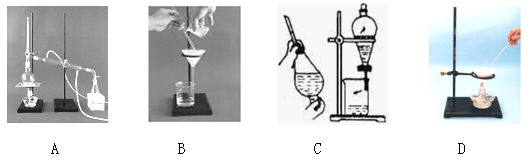
(6分)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
|
某实验小组用如图所示装置进行铜与浓硫酸反应的实验探究。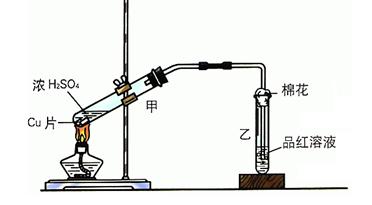
(1)写出甲中反应的化学方程式:。
(2)乙试管口的棉花应沾有的试剂是,其作用是。
(3)实验小组成员观察乙试管内液体变化是。
(4)充分反应后,若甲试管中有铜片剩余,继续向甲中加入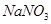 溶液,发现铜片溶解,此反应的离子方程式为。
溶液,发现铜片溶解,此反应的离子方程式为。
(5)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。(填字母)
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |