在如图所示的量热计中,将100mL0.50mol·L CH3COOH溶液 与100mL0.55mol·L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1.实验中某同学计算中和热,记录数据如下:

| 实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 醋酸溶液 |
氢氧化钠溶液 |
混合溶液 |
|
| 1 |
25.0 |
25.1 |
27.8 |
| 2 |
25.1 |
25.3 |
27.9 |
| 3 |
25.2 |
25.5 |
28.0 |
(1)试求CH3COOH的中和热△H 。
(2)CH3COOH的中和热的文献值为56.1KJ·mol-1,则请你分析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
(4)CH3COOH的中和热与盐酸的中和热绝对值相比, 的较大,原因是 。
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题: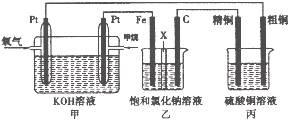
(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_L;丙装置中阴极析出铜的质量为g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_极,电解质溶液最好用_。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用作电极。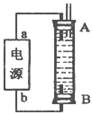
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H+ + S042-。
H+ + S042-。
请回答下列有关问题:
(1)Na2SO4溶液呈_(填“弱酸性”、“中性”或“弱碱性”),其理由是_
(用离子方程式表示)。
(2)H2SO4溶液与BaC12溶液反应的离子方程式为_。
(3)在0.l0mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是_(填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4一)+c(H2SO4) |
| B.c(OH-)="c(" HSO4-)+c(H+) |
| C.c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c( Na+)=2c(SO42-)+2c(HSO4-) |
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c( SO42-)=0. 029 mol·L-1,则0. 10 mol·L-1的H2SO4溶液中c( SO42-)0.029 mol·L-1(填“<’,、“>”或“=”),其理由是___。
(5)若25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=mol·L-1
中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去)。
请回答下列问题:
(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中。则a与b反应的离子方程式为
(2)若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,写出其褪色过程的离子方程式为
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mol-1的混合气体进行喷泉实验。假设溶质不扩散,实验完成后所得溶液的物质的量浓度为_mol·L-1。(小数点后保留2位有效数字)
(4)若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5。则上述反应的离子方程式为。
顺丁橡胶及高分子生物降解性材料PBS、聚γ-BL的合成路线如下:
已知: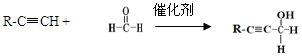
(1)B为饱和烃的含氧衍生物,用系统命名法命名,其名称为。
(2)D的官能团名称是。
(3)由B生成F的反应类型是。
(4)顺丁橡胶的顺式结构简式为。
(5)写出E与B聚合生成PBS的化学方程式。
(6)E有多种同分异构体,同时满足以下两个条件的同分异构体共有种,其中一种同分异体的核磁共振氢谱有两个吸收峰,峰面积之比为2:1, 其结构简式为。
a.含有酯基,不含醚键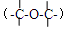
b.1mol该有机物与足量银氨溶液反应,生成4mol Ag
(7)由乙炔生成A的化学方程式为。
(8)由C生成聚γ-BL的化学方程式为。
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验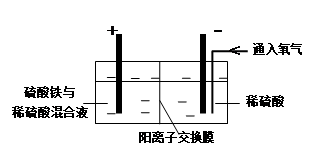
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是;加入有机萃取剂的目的是。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是。