某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| |
分组实验 |
催化剂 |
| ① |
10mL 5% H2O2溶液 |
无 |
| ② |
10mL 2% H2O2溶液 |
无 |
| ③ |
10mL 5% H2O2溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ④ |
10mL 5%H2O2溶液+少量HCl溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
| ⑤ |
10mL 5% H2O2溶液+少量NaOH溶液 |
1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .
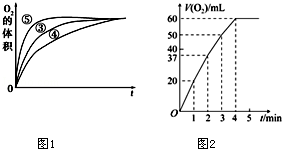
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: .
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)
(5)常温下H2O2溶液类似于二元弱酸溶液,H2O2的电离方程式为 .
随着生活水平的提高,人们越来越 关注自身的健康。请回答:
关注自身的健康。请回答:
(1)蛋白质是构成生命的基础物质,是日常膳食的重要组成部分。下列食物中富含蛋白质的是 。
A.苹果 B.白菜C.牛奶 D.米饭
(2)人体所需的营养物质中,水解后能生成高级脂肪酸和甘油的是;蛋白质水解的最终产物是;提纯蛋白质可以采用的一种方法是(填“盐析”或“过滤”)。
(3)向淀粉溶液中加入碘水 ,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
A.蔬菜应先洗后切 B.蔬菜应小火慢煮 C.维生素C可使溴水褪色
(4)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离 子方程式:
子方程式:
、。
下表列出了①~⑥六种元素在周期表中的位置:
| 族 周期 |
ⅠA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
请按要求回答下列问题。
(1)元素①的元素符号是。
(2)元素②的单质的电子式是。元素③与元素⑤形成化合物的电子式是。
(3)元素⑤的原子结构示意图是。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)。
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式)。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为;向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为。
现有下列四种物质:①NH4Cl、②Cl2、③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是(填序号,下同),遇到KSCN溶液能变红的是,易与空气中氧气反应的是,通常状况下呈黄绿色的是。
铜跟稀硝酸可发生反应:3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O。在该反应中,铜元素的化合价(填“升高”或“降低”),被(填“氧化”或“还 原”);硝酸体现_____________性,若反应中生成转移0.6mole,则生成___L NO(标况)。
原”);硝酸体现_____________性,若反应中生成转移0.6mole,则生成___L NO(标况)。
取体积相同(25mL)的两份0.10mol·L-1NaOH溶液,将其中一份放在空气中一段时间后,溶液的PH (填“增大”、“减小”或“不变”),其原因是。用已知浓度的盐酸中和上述两份溶液,若中和放置空气中一段时的那份消耗盐酸的体积为VA,另一份消耗盐酸的体积为VB,则
(1)以甲基橙为指示剂时,VA与VB的关系是。
(2)以酚酞为指示剂时,VA和VB的关系是 。
。