实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2+2H2O=4NaOH+O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会褪色,而实验中发现酚酞变红后又褪色。由此提出如下的猜想:
A.氧气有漂白性 B.氢氧化钠有漂白性 C.
[实验与判断]请完成下列表格:
| 实验编号 |
1 |
2 |
3 |
| 实验装置 |
 |
 |
 |
| 验证猜想 |
|
C |
|
| 实验现象 |
溶液变红后不褪色 |
||
| 实验说明 |
1、2的实验中氢氧化钠溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 |
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。

A.酚酞试剂
B.过氧化钠与水反应后的溶液
C.二氧化锰
D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
(2014届浙江省杭州市杭州学军中学高三第二次月考化学试卷)
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I- + 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。
(2014届北京市东城区普通校高三3月联考理综化学试卷)
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。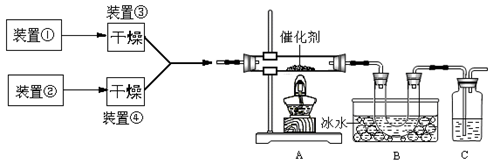
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
(2014届四川省资阳市4月高考模拟考试理综化学试卷)
Ⅰ、某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3,乙同学认为沉淀是CuCO3和Cu(OH)2的混合物。他们设计实验通过测定沉淀中CuCO3的质量分数来确定沉淀的组成。
(1)按照甲同学的观点,发生反应的离子方程式为: 。
(2)两同学利用下图所示装置进行测定: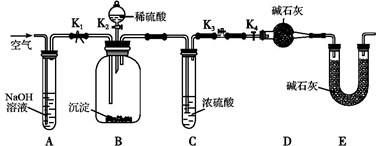
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有
A.易溶于水 B.难溶于水 C.颗粒较大 D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
① 往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式____ __。
② 往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是 。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
① 对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:只有SiO2假设2:可能有SiO2和CaCO3
假设3:可能有________________。
② 请设计方案对B品牌牙膏摩擦剂的成分进行验证。填写下表。限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B。 |
|
| 步骤2: |
|
| 步骤3: |
(4)已知C牌牙膏中的摩擦剂为CaCO3,为测定CaCO3的质量分数,取20.0g牙膏样品溶于水后过滤,将所得沉淀溶于100mL1mol/L的盐酸(假设所得溶液体积不变),从所得的溶液中取20.00mL,用1mol/L NaOH溶液进行滴定,消耗NaOH溶液5.00mL,则C品牌牙膏中CaCO3的质量分数为 _(保留四位有效数字)。.