氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:
S(s)+Cl2(g)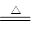 SCl2(l) (Ⅰ)
SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)===SOCl2(l)+ SO2(g) (Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。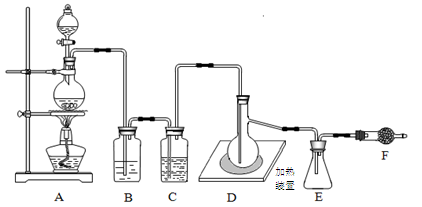
(1)仪器组装完成后,首先进行的一步操作是 ;反应前要先排尽系统中空气,此做法目的是 。
(2)装置B盛放的药品是 ,装置D中玻璃仪器的名称是 ,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 。
(3)实验时,为防止E中液体挥发,可采取的措施是______。装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是 。
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为______;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论______。
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测。请填写以下实验报告。
(1)实验目的:;
(2)实验步骤:
①称取10.0 g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0 g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为;
③反应完全后,称得装置总质量为119.8 g,则粗锌的纯度为;
(3)问题探究:(已知碱石灰为.Na()H和CaO的混合物)
①该实验中碱石灰的作用是;若不用碱石灰,则所测得的粗锌纯度将;(填“偏大”、“偏小”或“无影响”)。
②若将粗锌换成石灰石,原实验方案(填“能”或“不能”)用于石灰石样品纯度的测定,理由是。
下列A~E是初中化学中的五个实验装置,请按要求填空: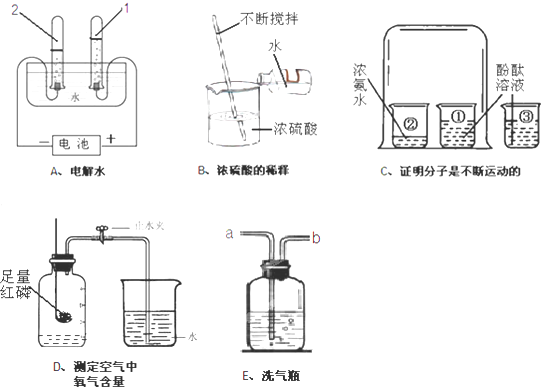
(1)A实验试管2中产生的气体是_________,试管1和2产生气体的体积比约为_________。
(2)C实验中烧杯3的作用是__________________________________________;
(3)D实验说明氧气的体积约占空气的_________,下列操作不妥的是_________。
①检查装置气密性 ②实验前夹紧止水夹
③冷却后再打开止水夹 ④选用教室内的空气
(4)若用E装置除去O2中的水蒸气,该液体试剂为_______,医院还用此装置来观察给病人输氧情况,导管_______(填“a” 或“b”)应连接病人吸氧气的塑胶管。
(5)上述实验中操作错误的是_______________________(填字母)。
在某浓度的NaOH溶液中滴加几滴酚酞试液,溶液立即呈红色,再向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去.回答下列问题:
(1)产生该现象的原因可能有:
①_________________________________________________________;
②_________________________________________________________.
(2)简述怎样用实验证明红色褪去的原因是①或者是②:_________________________
______________________________________________________.
拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).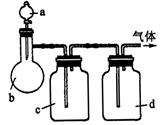
| 气体 |
a |
b |
c |
d |
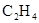 |
乙醇 |
浓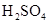 |
 溶液 溶液 |
浓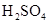 |
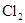 |
浓盐酸 |
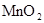 |
 溶液 溶液 |
浓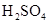 |
 |
饱和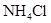 溶液 溶液 |
消石灰 |
 |
固体 |
| NO |
稀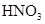 |
铜屑 |
 |
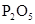 |
(1)上述方法中可以得到干燥、纯净的气体是____________.
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体____________,理由是____________.
②气体____________,理由是____________.
③气体____________,理由是____________.
④气体____________,理由是____________.
某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:
取样、、沉淀、、、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器有:玻璃棒、_____________________________________________
________________________________________________________________________,
③观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同);没有进行操作④,会________;