可以利用氧化锌粗品(含有Fe2O3、FeO、CuO)为原料制备纯净的氧化锌,其化学工艺流程如下: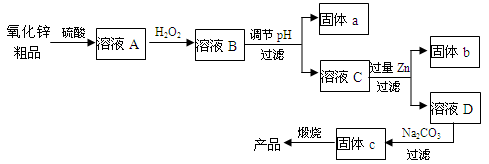
按要求回答下列问题:
(1)加双氧水主要作用是氧化溶液中的Fe2+,该反应的离子方程式为___________。
(2)调节pH主要是使溶液中的Fe3+生成沉淀而被除去,溶液pH对除Fe效率影响如图所示。则除Fe3+时应控制溶液的pH为 (填序号)。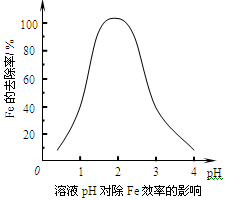
a.3.5~4.0 b.2.5~3.5
c.1.5~2.5 d.0.5~1.5
(3)固体b为_________(填化学式),固体c为碱式碳酸锌,锻烧固体c的化学方程式为__________。
(4)工业上也可以将氧化锌粗品采用碱溶的方法,将氧化锌转化为Na2[Zn(OH)4]溶液,然后电解该溶液制取锌,以石墨为电极电解时,阴极的电极反应式为___________,当生成1mol锌时,阳极上生成气体在标准状况下的体积为__________L。“纸质电池”的纸片内充入的是水和氧化锌组成的电解液,纸的一边镀锌另一边镀二氧化锰,电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),该电池的负极反应式为_________。
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ②→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
| 初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
| 最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
| V标(mL) |
24.65 |
20.00 |
20.10 |
19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)甲、乙两仪器的名称是 、 。
(2)利用B装置可制取的气体有 (写出两种即可)。
(3)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 mol·L−1(保留2位有效数值,气体按标准状况计算)。
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + ____ H+ =" ____" Mn2+ + ____ CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):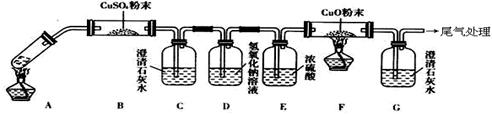
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色。据此回答:
上述装置中,D的作用是__________________.
乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化)。则下列关系合理的是
A.c(Na+)+c(H+)=c(HC2O4—)+c(OH—)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)="0.2" mol·L-1
C. c(HC2O4-)>c(C2O42—)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—)
某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: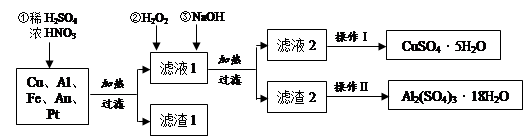
(1)在金属混合物与酸的反应中,表现氧化性的离子为;得到滤渣1的主要成分为。
(2)第②步加H2O2后发生反应的离子方程式为;
通过加入NaOH调节溶液的pH,其目的是;
(3)操作Ⅰ中包括的实验步骤有、过滤;
(4)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3·18H2O 。下列是操作Ⅱ的一种实验方案。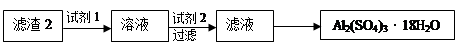
实验中:试剂1是,试剂2是。(填化学式)
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是__________________________。
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:____________________________、_________________________;纠正上述错误后,请你从绿色化学的角度出发,对装置2提出改进建议,使装置2既能控制反应的进行,又能减少氮氧化物的排放:__________________________________________.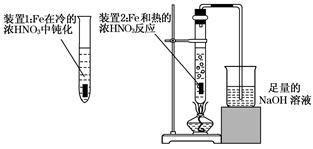
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解(Cu有剩余)。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是___________。
②丁同学认为丙同学的结论不完全正确.他的理由是_________________________.
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象_________________________________________。