可逆反应mA(g)+nB(g) pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
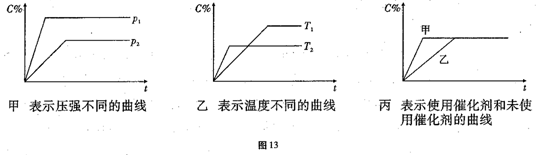
(1)据上述信息试比较下列大小关系:P1_______ P2,T1_______T2,△H_____0,△S_____0(增色填“﹥”“﹤”或“=”),图丙中使用催化剂的是_______反应线。
(2)该反应在_______(填“高温”或“低温”)下能自发进行。
(3)当该反应在两个体积相等的恒容密闭容器中进行反应时,如图:

请分析丙容器和丁容器达到平衡时C%(产物C的体积分数)是否可能相等,_____ (填“能”或“不能”),其原因是_____ _____ _____ 。
(4)假设第(3)问中,图中物质的量不变,在相同温度下达到平衡时丁中A、B的浓度分别是丙中A、B的浓度的ω倍,求m:n的值为 。
(8分)2molCO2的质量为 g,含分子数约为个,在标准状况下所占有的体积约为L,含氧原子的物质的量为mol。
(4分)小苏打是厨房里的常见物质,是发酵粉的主要成分,请写出小苏打的化学
式,若食盐中可能混入了少量小苏打,用下列厨房中的进行检验。
| A.白酒 | B.食醋 | C.酱油 | D.白糖 |
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。
正极反应,
负投反应。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。
(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为。
回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H0(填“>”、“<”、
或“无法确定”)。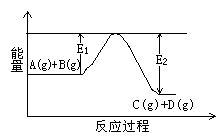
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应:。
II若试管内液面下降,则发生腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在(填“甲”或“乙”)溶液中腐蚀的速度快。
已知: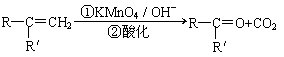
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是,名称是。
(2)G与F的相对分子质量之差为4,则G具有的性质是(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是,
该反应类型是反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
、。
(5)A转化为B和F的化学方程式是。