酸牛奶是人们喜爱的一种营养饮料,酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖,酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:CH3CH(OH)COOH。工业上它可由乙烯来合成,方法如下:
CH2=CH2 A
A B
B CH3CHO
CH3CHO C
C CH3CH(OH)COOH
CH3CH(OH)COOH
(提示:(1)CH3Cl+NaOH CH3OH+NaCl,
CH3OH+NaCl, 的加成类似于
的加成类似于 的加成)
的加成)
(1)乳酸所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③乳酸在一定条件合成聚乳酸 。
(3)写出符合下列要求的乳酸的所有同分异构体的结构简式 。
a、属于酯类 b、含有﹣OH c、能发生银镜反应.
按要求完成下列各小题。
(1)甲中显酸性的官能团是(填名称)。
(2)下列关于乙的说法正确的是(填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式。
(4)已知以下信息:

1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g)ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。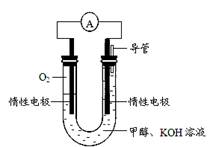
该电池正极的电极反应式为;该电池工作时,溶液中的OH-向(填“正”或“负”)极移动。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有。
(3)滤渣A的主要成分为;滤渣A的用途是(写一种)。
(4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ _________。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为、。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为。
(3)反应②的离子方程式为。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论)。
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为,它比同主族其他元素的氢化物沸点高的原因是。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象:。