I.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:
(1)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________。
(2)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的______H2(相同状况),则开始时反应速率的大小关系为__________,反应所需时间的长短关系是__________。
II.常温下,有浓度均为1 mol·L-1的下列四种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)溶液pH由大到小的顺序是______,其中由水电离的H+浓度最小的是______。(均填序号)
(2)③中各离子浓度由大到小的顺序是______ __,升高温度,NH4Cl溶液的pH (填“升高”、“降低”或“不变”)
(3)向③中通入少量氨气,此时 的值______(填“增大”、“减小”或“不变”)。
的值______(填“增大”、“减小”或“不变”)。
(4)将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示。请回答下列问题: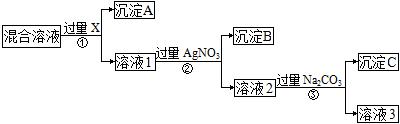
(1)试剂X最好是 (填化学式),检验X是否加入过量的方法 。
(2)写出步骤②的离子反应方程式 。
(3)按此实验方案得到的溶液3中肯定含有________(填化学式)杂质;为了除这个杂质,可以向溶液3中加入过量的________,之后若要获得纯固体NaNO3,还需进行的实验操作是___________(填操作名称)。
下图所示是分离混合物时常用的仪器,回答下列问题: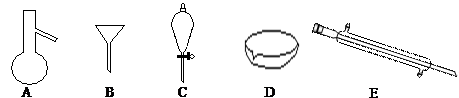
(1)写出上述仪器的名称A ,C ,E 。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙: ;②花生油和水: 。
(3)关于仪器的使用,下列说法不正确的是 。
| A.A仪器可以用酒精灯直接加热 |
| B.B仪器可以用于过滤 |
| C.C仪器在放出液体时应打开上边的塞子 |
| D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌 |
E.蒸馏时,E仪器中水的流向是上口进,下口出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象? 。
(1)常温下,将pH=10和pH=12的NaOH溶液以1∶1的体积比混合,则混合后所得溶液的pH约为________。
(2)0.2 mol·L-1 NaHSO4和0.1 mol·L-1 BaCl2溶液按等体积混合后,则溶液的pH等于________。
(3)用pH=4和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比为________。
泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是:_____________;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:____________。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3,阻止火势蔓延。其相关的化学方程式为:_________________。
25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ/mol
(1)在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4 kJ。其原因是 。
(2)为了提高NH3的产率,应如何选择反应条件?