【选修2:化学与技术】工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝。
(1)一座大型硫酸厂同时又是一座能源工厂,硫酸厂生产过程中的余热若能充分回收利用,不仅不需要外界供应能源,而且还可以向外界输出大量的热能。硫酸厂产生余热的主要设备有________。
(2)硫酸厂产生的大量烧渣(硫铁矿煅烧后的灰渣)的用途是________(写一种即可);写出电解精炼铜阳极泥的一种用途________。
(3)工业制硫酸的尾气中含有的少量SO2,可先用氨水吸收,再用稀硫酸处理。
①该反应的化学方程式为_________; ②这样处理的优点是____________________。
(4)干熄焦技术是将炼焦炉推出的约1 000℃的赤热焦炭,在熄焦室中被其逆流的冷惰性气体(主要成分是氮气,温度在170~190℃)熄灭,被加热到700~800℃的惰性气体经除尘后进入余热锅炉,产生的过热蒸气送往汽轮发电机发电。干熄1 t焦炭可产生500 kg过热蒸气,可折合成46 kg标准煤。举出两例采用逆流原理的化工设备或化学仪器________、________。
(5)下图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式 。

(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+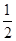 O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+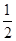 O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
已知: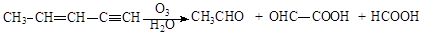
完成下列填空:
(1)分子式为C8H8的某烃,在臭氧作用下发生反应为:
则该烃的结构简式为______________________________________。
(2)若分子式为C8H8的某烃其一氯代物只有一种,写出1种其可能的结构简式_________。
分子式为C8H8的烃有很多,其中有一种苯乙烯,性质活泼,易被氧化,是合成橡胶和塑料的单体,用途广泛。苯乙烯可以通过下列途径制备(反应条件下所有物质均呈气态):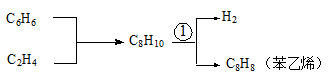
(3)上述流程中各物质,属于苯的同系物的是__________(填结构简式);能与溴水发生加成反应的是_________________________(均填结构简式)
(4)反应①是强吸热可逆反应。要既快又多地获取苯乙烯,反应①适宜条件是__________;为了进一步提高反应物的转化率,有研究者用加入O2与H2反应的方法获取了更多的苯乙烯,试推测其中的原因___________(写出一条)。
工业制纯碱广泛采用的两种生产流程可以用以下示意图简要表示。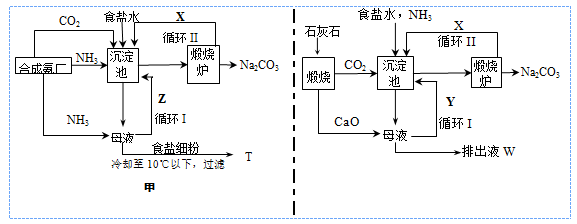
完成下列填空:
(1)用甲流程生产纯碱的方法称为_________________法。
(2)沉淀池中发生反应的化学方程式为_______________________________。
(3)T是________; W中除Ca(OH)2外,溶质的主要成分是_________(均填化学式)。
(4)甲流程中设计循环I的目的是________________;乙流程中设计循环I的目的是_____________。
(5)在乙流程中,若通入NH3 44.8 L(已折合成标准状况下)可以得到纯碱100.0 g,则NH3的利用率为__________。
(6)若制碱厂欲利用产生的氯化钙废液制取硝酸钙(Ca(NO3)2·4H2O),设计一个经济可行的方案,用流程图表示。
Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。
完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___________________________。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式________。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是_________________。向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐_____________(填“变大”、“变小”),生成的沉淀是_____________;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___________。
a.c(Na+) = c(S2O32-) + 2 c(HSO3-) + 2c(H2SO3) + 2 c(HS-)
b.c(Na+) + c(H+) =" 2" c(S2O32-) + c(HSO3-) + c(HS-) + c(OH-)
c.c(Na+) =" 2" c(HS-)
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4 + 2 NaClO3 + H2SO4 → Na2SO4 + 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有 种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O → 4 NaClO3 + 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O → NaClO3 + 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。