下列离子方程式改写成化学方程式正确的是
| A.Cu2+ + 2OH—= Cu(OH)2↓ CuCO3+2NaOH==Cu(OH)2↓+Na2CO3 |
| B.CO32— + 2H+ = CO2↑+H2O BaCO3+2HCl==BaCl2+CO2↑+H2O |
| C.Ca2+ + CO32— = CaCO3↓ Ca(NO3)2+Na2CO3==CaCO3↓+2NaNO3 |
| D.H+ + OH—= H2O 2KOH+H2SO4==K2SO4+2H2O |
实验室可用下图所示装置干燥、收集某气体R,并吸收多余的R,则R是 ( )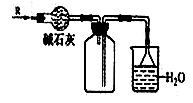
| A.O2 | B.HCl | C.Cl2 | D.NH3 |
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是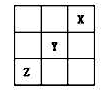
| A.Z一定是活泼的金属元素 |
| B.Y的最高价氧化物的水化物是一种强酸 |
| C.1molX的单质跟足量水反应时,发生转移的电子为2mol |
| D.Y的氢化物稳定性大于Z的氢化物稳定性 |
下列各组物质中,互为同素异形体的是
| A.T2O与D2O | B.40 19K与4020Ca | C.O2和O3 | D.21H和31H |
元素性质呈周期性变化的决定因素是()
| A.元素原子半径大小呈周期性变化 | B.元素的相对原子质量依次递增 |
| C.元素原子核外电子排布呈周期性变化 | D.元素的最高正化合价呈周期性变化 |
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是()
| A.制催化剂的材料 | B.耐高温、耐腐蚀的合金材料 |
| C.制农药的材料 | D.半导体材料 |