AX(g)+2X2(g) AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
(1)计算实验1反应开始至达到平衡时的反应速率v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为______(填实验序号);
与实验1相比,其他两组改变的实验条件及判断依据是:2____________,3_________。
(3)用p1表示开始时总压强,p2表示平衡时总压强,α表示AX的平衡转化率,则α的表达式为____________;实验1和2的平衡转化率:α1为___________,α2为_________________。
恒容容积为VL的密闭容器中发生2NO2  2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。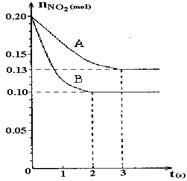
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是。
A.有、无催化剂 B.温度不同
C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式:,并比较K800℃K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)=。
(4)不能说明该反应已达到平衡状态的是。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变D.气体的密度保持不变
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号)。
第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金。某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金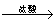 溶液
溶液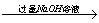 悬浊液
悬浊液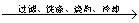 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)写出方案一中发生反应的离子方程式。
(2)实验小组根据方案二设计了两个实验装置,如下圈(图中的铁架台已省略)。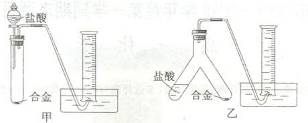
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的。
(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量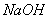 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入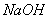 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示: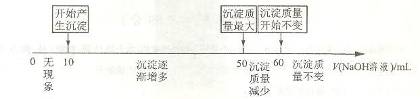
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? (选填“能”或“不能”)_____________.
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由。
②若能求出合金中镁的质量分数,则镁的质量分数为。
某工厂用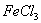 溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:2
溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:2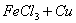 =
=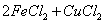 。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色.
②取10mL废液,加入足量的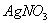 溶液,析出沉淀8.6l g。
溶液,析出沉淀8.6l g。
③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是。
(2) 10mL废液中氯离子的物质的量浓度是mol/L。
(3)10mL废液中铜离子的物质的量是mol。
下图中A是现代社会中用量最多的金属,F为红褐色沉淀。请根据下图所示的转化关系回答下列问题: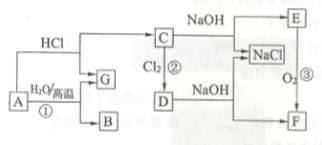
(1)分别写出反应①、反应③的化学方程式:;。
(2)写出反应②的离子方程式:。
氯气是一种重要的化工原料,在生产和生活中应用十分广泛。
已知: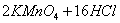 (浓)="==="
(浓)="===" 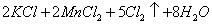 ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。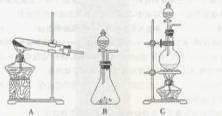
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式:。
(3)实验室收集氯气的方法是。
(4)常用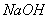 溶液吸收氯气防止污染,写出该反应的离子方程式。
溶液吸收氯气防止污染,写出该反应的离子方程式。