某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习。
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3 2NaNO2+O2↑;
2NaNO2+O2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3 2Ag+2NO2↑+O2↑.
2Ag+2NO2↑+O2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素既有+2价又有+3价。
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入___________溶液。
(3)实验现象:实验①_________;实验②溶液不褪色。
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是______________________。
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用Ⅰ装置收集气体,恰好收集到27mL红棕色气体。
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到_____ mL气体。【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是________(填字母序号)。
| A.1:2:3 | B.l:2:2 | C.2:1:3 | D.3:8:5 |
(2)若取按上述比例混合的固体硝酸盐1mol溶于200mL 3mol•L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为__________g。
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 |
颜色、性质 |
物质 |
颜色、性质 |
| 氢氧化铜Cu(OH)2 |
蓝色固体不溶于水 |
硫酸铜(CuSO4) |
溶液呈蓝色 |
| 氧化亚铜(CuO) |
红色固体不溶于水 |
氯化铜(CuCl2) |
溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) |
白色固体不溶于水 |
碱式氯化铜 |
绿色固体不溶于水 |
Ⅱ、探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
(2)实验验证:取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物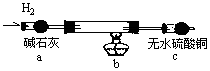
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是
;②在c装置后将气体通入中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入后继续电解,出现白色物质。
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2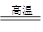 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
II反应结束后,将乙瓶中的溶液进行如下处理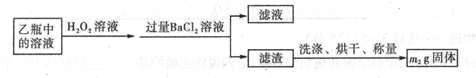
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
乙酸乙酯是重要的化工原料。实验室合成乙酸乙酯的装置如下图所示。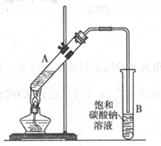
有关数据及副反应: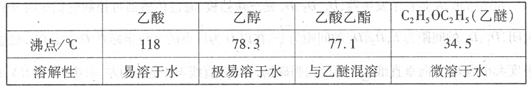
副反应:
C2H5OH+C2H5OH C2H5OC2H5+H2O
C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E. Fe2(SO4)3 |
④反应中加人少量FeSO4可加速铜的氧化,用离子方程式解释其原因、
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液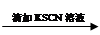 无明显现象
无明显现象 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液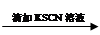 溶液变红
溶液变红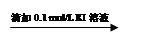 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液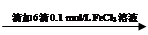 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液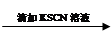 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液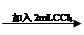 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6]检验的离子是。
② 黄色溶液中含有的溶质微粒有K+、Cl-和。
③ 综合上述实验现象,得出的实验结论是。