已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 |
Fe3+ |
Fe2+ |
Al3+ |
Ni2+ |
| 开始沉淀的pH |
1.1 |
5.8 |
3.0 |
6.8 |
| 完全沉淀的pH |
3.2 |
8.8 |
5.0 |
9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施________________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式____________________。
(3)pH的调控范围为_____________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成。
(4)写出“沉镍”时反应的离子方程式______,证明Ni2+已经沉淀完全的实验步骤及现象是________,
(5)操作a的内容为___________。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。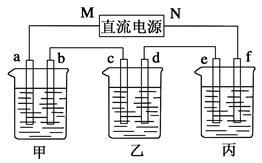
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题: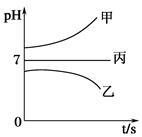
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA-HA-
H++HA-HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g) p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,B物质n mol,则达到平衡时 A、B的转化率____________.(填“相等”或“不等”)
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间T的关系如图3所示。则T1(填“>”、“<”或“=”) T2,该反应的正反应的△H(填“>”、“<”或“=”) 0。
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图4所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。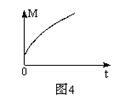
①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)______ 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
(4)若该反应的逆反应速率与时间的关系如下图所示:
可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t2时改变的条件是 。
Ⅰ.图甲是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示): 。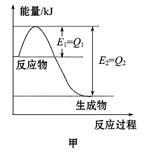
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ·mol-1,
2NH3(g)ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l)ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH= ;
4NH3(g)+3O2(g)ΔH= ;
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO。两步反应的能量变化示意图如下: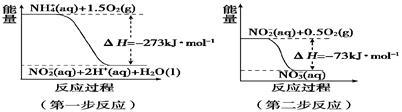
①第一步反应是________反应(填“放热”或“吸热”),判断依据是______________________________________。
②1 mol NH4+ (aq) 全部氧化成NO3-(aq)的热化学方程式是__ ________。
结合下表回答下列问题(均为25℃时的数据)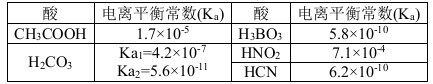
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+ OH-= B(OH)4-, 则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c (NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH -) ⑥
(4)右图描述的是醋酸与HNO2在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。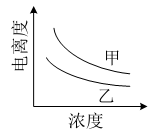
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
| A.H2CO3、HCO3-、 CH3COO-、CN- | B.HCO3-、 CH3COOH、CN-、CO32— |
| C.HCN、 HCO3-、CN-、CO32— | D.HCN、 HCO3-、CH3COO-、CN- |
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)。