离子方程式2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O可以表示( )
| A.Ca(HCO3)2与NaOH溶液反应 | B.Ba(HCO3)2与澄清石灰水反应 |
| C.Ca(HCO3)2与澄清石灰水反应 | D.NH4HCO3与澄清石灰水反应 |
a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为()
①(a+b)×63 g②(a+b)×189 g
③(a+b) mol④(cV-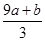 ) mol
) mol
| A.①④ | B.②③ | C.①③ | D.②④ |
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是用FeSO4把废水中的Cr2O72-还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(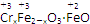 )。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是()
)。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是()
| A.x=1,a=5 | B.x=0.5,a=8 |
| C.x=1,a=10 | D.x=0.5,a=10 |
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是()
| 已知 |
类推 |
|
| A |
将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ |
将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
| B |
稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓ +2H2O |
NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C |
铁和氯气反应:2Fe+3Cl2 2FeCl3 2FeCl3 |
铁和碘单质反应:2Fe+3I2 2FeI3 2FeI3 |
| D |
向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HclO |
向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
符合前者条件的溶液中一定可以大量共存的离子组是()
| A.既能溶解Al(OH)3,又能溶解H2SiO3的溶液:Na+、Fe2+、SO42-、Cl- |
| B.能使酚酞溶液变红的溶液:Na+、NO3-、S2-、Br- |
| C.投入铁片能产生H2的无色溶液:H+、Mg2+、SO42-、NO3- |
| D.含有大量Fe3+的溶液:Na+、Al3+、NO3-、SCN- |
常温下,向20 L的真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5)。反应完全后,容器内气体可能达到的最大密度是()
| A.24.5 g/L | B.14.4 g/L | C.8 g/L | D.5.19 g/L |