化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。 某化学兴趣小组对氯及其化合物进行探究。
(1)漂白精广泛用于饮用水消毒、医院环境消毒、游泳池消毒。资料查阅:随漂白精溶液酸性的增强,溶液会变为黄绿色。出现该现象的原因为 (用离子方程式表示)。

(2)实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100 左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。

①仪器X的名称为 。
②制备三氯化铁的反应开始前,需排除装置中的空气,采取的方法是 。
③实验装置的连接顺序是a 。
(3)设计实验证明FeCL3的氧化性比I2强: 。
(12分)某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。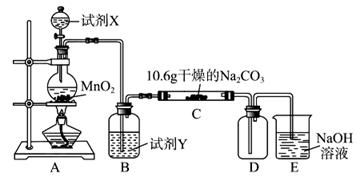
(1)写出装置A中发生反应的化学方程式:。
(2)写出试剂Y的名称:。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和;
假设二:存在三种成分: NaHCO3和、。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为。
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: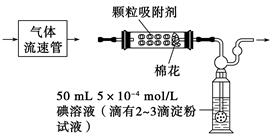
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定___________________________________________________
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100 mL 5×10-4 mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,___________________________
第二步:___________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。
(2)乙同学拟用如图所示简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4 mol/L的碘溶液,注入图中所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为________次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:__________________、______________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_________________________。
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置。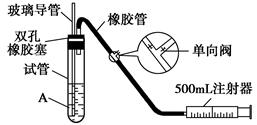
(1).检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后_______________________________________(填写操作方法)时,将会看到________________(填写实验现象),则证明该装置的气密性良好( )
A.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
B.向内轻轻推动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
C.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有水柱上升
D.手握试管 浸没在水中的玻璃导管口有气泡冒出
(2).向试管中加入0.000 5 mol/L碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变成______色时反应恰好完全进行,此时停止抽气( )
A.红 无 B.无 红 C.蓝 无 D.无 蓝
(3).我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
| 浓度限值/mg/m3 |
||
| 一级标准 |
二极标准 |
三级标准 |
| 0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。反应恰好完全进行,记录抽气次数和结果如下(假设每次抽气500 mL)。
| 分组 |
第一小组 |
第二小组 |
| 抽气次数 |
100 |
120 |
| SO2含量/mg/m3 |
0.64 |
0.53 |
____小组的测定结果正确( )
A.第一 B.第二
C.都正确 D.都不正确
(4).判断该地点的空气中SO2的含量属于________标准( )
A.一级 B.二级 C.三级 D.四级
(5).实验结果产生较大偏差的原因是(所用装置和药品均无问题)( )
A.抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差
B.抽气速度过慢,造成空气中SO2无法与碘水充分反应,产生较大的误差
C.装置漏气,造成空气中SO2无法与碘水充分反应,产生较大的误差
D.抽气速度过快,造成空气中O2与碘水充分反应,产生较大的误差
某一种胃药药片的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去Vx mL达到滴定终点;
④加入25 mL 0.1 mol/L的盐酸溶液。
(1)写出全部实验过程的步骤顺序________(写编号顺序)。
(2)如图所示仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称)。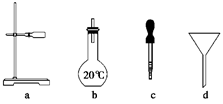
(3)配制上述溶液应选用的容量瓶规格分别为________(填字母)。
| A.50 mL,50 mL | B.100 mL,100 mL |
| C.100 mL,150 mL | D.250 mL,250 mL |
(4)写出反应的化学方程式____________________________________________。
(5)胃药中含CaCO3的质量________g(写出计算式并加以文字说明)。
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
②_______________________________________
③_______________________________________
④_______________________________________
(2)合金样品用铜网包裹的目的是:_______________________________________