1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是( )
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
“熵”可看作是“混乱度”,它的符号是“S”。下列变化中,△S<0(“混乱度”减小)的是
| A.3Fe(s)+4H2O(g) =Fe3O4(s)+4H2(g) |
| B.2NO2(g) =N2O4(l) |
| C.2IBr(l) =I2(s)+Br2(g) |
| D.(NH4)2CO3(s) =2NH3(g)+CO2(g)+2H2O(g) |
100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的
| A.碳酸钠(固体) | B.水 |
| C.硫酸钾溶液 | D.CH3COONa(固体) |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中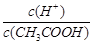 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |
在同温同压下,合成氨反应N2+3H2=2NH3进行到某时刻达到平衡.起始时N2和H2共120体积,平衡时总体积为70体积,则原混合气体中N2和H2的体积比可能为:
| A.1:3 | B.9:15 | C.5:19 | D.1:1 |
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:
3A(g)+ B(g)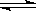 nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
| A.1 | B.2 | C.3 | D.4 |