过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.02 |
20.00 |
24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
| 实验序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 双氧水(mL) |
0.5 |
0.4 |
0.6 |
0.5 |
|
|
|
| pH |
11 |
11 |
11 |
10 |
|
|
|
| 反应时间 |
3 |
3 |
3 |
3 |
|
|
|
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。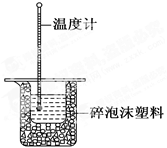
(2)烧杯间填满碎泡沫塑料的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值(填“偏大” “偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热数值会(填“偏大”“偏小”或“无影响”)
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
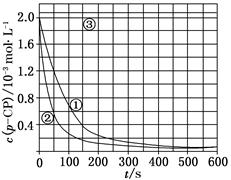
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________________和______________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为____________________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
| 醋酸溶液浓度(mol·L-1) |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案
________________________________________
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,
通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。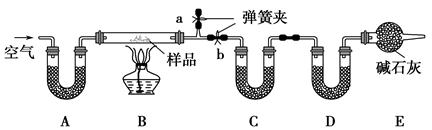
(1)加热前通入空气的目的是,
操作方法为。
(2)装置A、C、D中盛放的试剂分别为:A,
C,D。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将;若撤去E装置,则测得Na2CO3·10H2O的含量将。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为(用含w、m1、m2的代数式表示)。
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;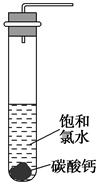
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有(填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。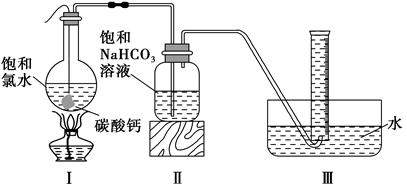
请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是。