雾霾天气严重影响人们的生活,氮氧化物和硫氧化物是造成雾霾的主要原因之一。
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
| 离子 |
K+ |
Na+ |
NH4+ |
SO32- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
7×10-6 |
3×10-6 |
2×10-5 |
3×10-5 |
5×10-5 |
2×10-5 |
根据表中数据判断该试样的pH=_______;该表有一处笔误,请你指正_____________________。
Ⅱ.消除氮氧化物和硫化物有多种方法。
【方法一 】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3产品的流程图如图1(Ce为铈元素):

(2)装置Ⅰ中的主要反应的离子方程式为_____________________________。
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生______________mol Ce4+。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度_____________。(结果保留2位有效数字)
【方法二 】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图2所示:
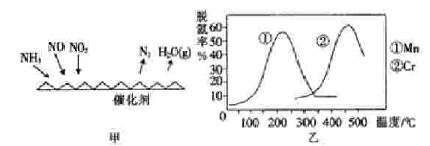
(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为____________。
(6)用Fe做催化剂时,在氨气足量的情况下,不同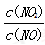 =1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
【方法三 】用活性炭还原法可以处理氮氧化物。
反应原理:1/2C(s)+NO(g) 1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
在T1℃时,反应进行到不同的时间测得各物质的浓度如下:

(7)T1℃时,该反应的平衡常数K=_________________________。
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______。
(4分)已知:CH2=CH-CH=CH2和Br2按物质的量之比1:1发生加成反应时,可得到两种产物:CH2BrCHBrCH=CH2与CH2BrCH=CHCH2Br,
则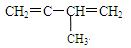
①和Br2 按物质的量之比1:1发生加成反应时,可得到种产物
②和HBr按物质的量之比1:1发生加成反应时,可得到种产物。
如 图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)
图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g) 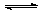 Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答: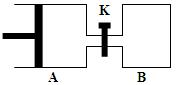
⑴A中X的转化率为。
⑵A、B中X转化率大小关系为AB(填“>”、
“<”、“="”" )
⑶打开K,一段时间后又达到新的平衡时,A的体积为L(连通管中气体体积不计)
某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示。则该反应的化学方程式为;反应开始至2分钟,能否用C表示反应速率吗?(填“能”或不能”),原因。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
⑴若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
⑵若C为气体,且m+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
⑶如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。