下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
| A.Ba2+、NO3-、NH4+、Cl- | B.Mg2+、NH4+、SO42-、K+ |
| C.K+、Ba2+、Cl-、HSO3- | D.Ca2+、HCO3-、NH4+、AlO2- |
已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO。某温度下,向
pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是 ( )
A. .该温度高于25℃
B. c(H+)=c(OH-)+c(SO)
C水电离出来的c(H+)=1×10-10mol·L-1.
D该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
下列溶液中一定显酸性的是()
| A.溶液的pH<7 | B.溶液中:c( H+)>c(OH-) |
| C.滴加甲基橙后溶液显黄色 | D.滴加酚酞后溶液显无色 |
下列热化学方程式,正确的是()
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ  ·mol-1 ·mol-1 |
B.稀的强酸和稀的强碱溶液反应的热化学方程式均为: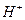 +OH-H2O(1); +OH-H2O(1);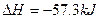 ·mol-1 ·mol-1 |
| C.在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ。则: 2H2O(1)2H2(g)+O2(g);△H= +571.6kJ·mol-1 |
| D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: |
N2(g)+3 H2(g) 2NH3(g)△H= -38.6kJ·mol-1
2NH3(g)△H= -38.6kJ·mol-1
已知反应mX(g)+nY(g)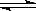 qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
用蒸馏水稀释1 mol/L醋酸时,始终保持增大趋势的是( )
| A.溶液中的c(CH3COO-) | B.溶液中的c(H+) |
| C.溶液中的c(CH3COOH) | D.溶液中的c(OH-) |