为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ 3H2(g) 2NH3(g)的△H_______0(填“>”或“<”)。
2NH3(g)的△H_______0(填“>”或“<”)。

②在 温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
(2)利用图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
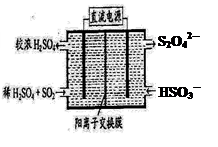
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
在生产生活中,会遇到各种各样的化学反应,请写出下面几例相关的化学方程式:
(1)胃舒平中含有氢氧化铝,可用来治疗胃酸(盐酸)过多:(2)碳铵(NH4HCO3)是一种常用化肥,应保存于阴凉处,高温时会发生分解:
写出区别下列物质的方法或试剂:
(1)丝绸与棉布(2)氯化钠与氯化钾
(3)硫酸铵与氯化铵(4)碳酸钠与硝酸钠
0.5mol H3PO4的质量是_______g,含______个H3PO4分子,含______mol氧原子
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K= ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 |
电离方程式 |
电离平衡常数K |
| CH3COOH |
CH3COOH H++CH3COO- |
1.75×10-5 |
| H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1=4.4×10-7 K2=4.7×10-11 |
| H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值________(填“变大”、“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性相对强弱的关系是_____________________________________________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是________,酸性最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,总有:,产生此现象的原因是________________________________________________________________________。
已知反应:Fe(s)+CO2(g)═FeO(s)+CO(g)△H="a" kJ•mol﹣1,测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的化学平衡常数表达式为K=,a0(填“大于”、“小于”或“等于”).若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则此时v(CO)为.
(2)若在700℃时该反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有(填序号).
A缩小反应容器的体积 B通入适量CO2 C加入适量铁
D升高温度到900℃E使用合适的催化剂