碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:
KI + CuSO4 → A (白色)↓+ K2SO4 + I2
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O  H3O++ OH-),生成的阳离子为 ;阴离子为 。
H3O++ OH-),生成的阳离子为 ;阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式: , 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_________mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式: 。
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: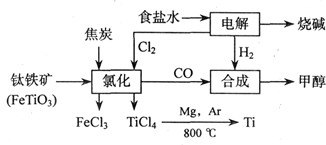
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应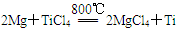 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ___mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 __;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 _____。
CYP73A1炔抑制剂的合成路线如下: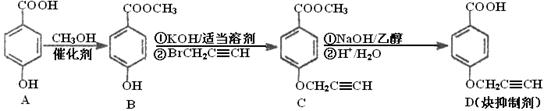
(1)化合物A核磁共振氢谱有____________种蜂。
(2)化合物C中含氧官能团有_______________、______________(填名称)。
(3)鉴别化合物B和C最适宜的试剂是____________________。
(4)写出A—B的化学方程式_____________________________。
(5)B的同分异构体很多,符合下列条件的异构体有______________种。
①苯的衍生物②含有羧基和羟基③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图。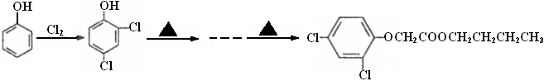
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下: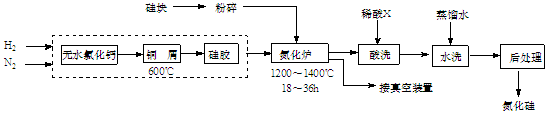
(1)净化N2和H2时,铜屑的作用是:;硅胶的作用是。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度:;体系中要通入适量的氢气是为了。
(3)X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为:。
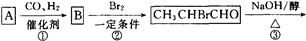
化合物A是来自石油的一种基本化工原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
已知: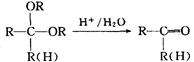
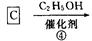
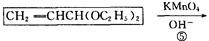

请回答下列问题;
⑴、写出有关物质的结构简式:A:;B:;C:;D:。
⑵、指出反应⑤的反应类型。
⑶、写出反应③的化学方程式。
⑷、反应④的目的是。