(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);

(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7 ②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体 ④1mol/L的HF水溶液能使紫色石蕊试液变红
有A、B、C、D、E、X、Y七种元素都是元素周期表中前36号元素。其相关信息如下:
| 相关信息 |
|
| ① |
A的基态原子2p轨道中有三个未成对电子 |
| ② |
A、B元素的常见单质是构成空气的主要成分 |
| ③ |
C 原子基态时最外层电子数是其内层电子总数的2倍 |
| ④ |
D 原子核外占有9个轨道,且只有1个未成对电子 |
| ⑤ |
E、X、Y三种元素处于第4周期;E元素的正三价离子的3d亚层为半充满,X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;Y元素原子的4p轨道上有3个未成对电子 |
(1)B元素原子的价层电子的电子排布图为
(2)X的基态原子的电子排布式为。
(3)指出E元素在元素周期表中的位置____________________。
(4)D离子结构示意图是。
(5)比较A、B、C三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示)。
(6)A元素最高价氧化物对应的水化物的稀溶液与X 反应的离子方程式为。
(7)已知化合物Y2B3在稀硫酸溶液中可被金属锌还原为YH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式是__________________________________________。
(1)①常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是。(填选项)
| A.pH= 4的醋酸 |
| B.pH=10的NaOH溶液 |
| C.pH=9的Na2CO3溶液 |
| D.pH= 2的硫酸 |
E.pH= 4的NH4Cl溶液
(2)在100℃时,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=。(混合时溶液体积变化忽略不计)
(3)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应。若混合后溶液呈中性,
则ab(填“<”、“=”或“>”)。
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应。若a=b,则反应后溶液中离子浓度从大到小的顺序是。
(5)氯化铝水溶液呈酸性 ,原因是(用离子方程式表示):______________________。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(6)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
氧化亚铜(Cu2O)是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4 = CuSO4 +Cu+H2O
②Cu2O+ 4HCl = 2HCuCl2 + H2O
③3Cu2O + 14HNO3(稀) = 6Cu(NO3)2 + 2NO↑+ 7H2O
(1)Cu2O中Cu的化合价为_____________。
(2)反应①中氧化剂为____________,还原剂为___________。
(3)反应②_________(填“是”或“不是”)氧化还原反应,若是请说明转移电子情况,若不是请说明判断依据_______________________。
(4)请写出反应③的离子方程式________________________;生成标准状况下22.4L NO,转移电子数为_________,做氧化剂的硝酸的物质的量为_______。
某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题: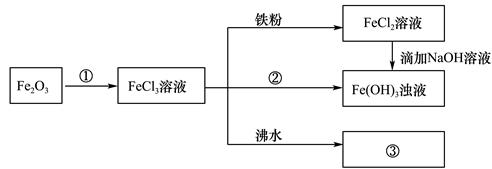
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_________,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
硝酸是一种具有强氧化性、强腐蚀性的无机酸,在储运过程中要严防泄漏。回答下列有关问题:
(1)硝酸储运罐子上应贴有的安全标识是(填序号)__________
① ②
② ③
③ ④
④
(2)一般在运输浓硝酸时采用的储藏罐材料是_____(填序号),原因是_________。
①铁②铝③铜④陶瓷
(3)从硝酸泄漏现场可以看到大量的红棕色气体弥漫,该红棕色气体的成分是。
(4)由于硝酸泄漏后与其他物质发生反应,并放出大量的热,故可在地面铺撒______(填序号),并及时用水降温。
①氯化钙②氯化钠③生石灰④熟石灰