消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol-1
③H2O(g)=H2O(l)ΔH=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①不能作为判断反应达到化学平衡状态的依据是___ ____
A.容器内CO2的浓度保持不变 B.v正(N2)="2" v正(NO) C.容器内压强保持不变
D.混合气体的密度保持不变 E.混合气体的平均相对分子质量保持不变
②计算该温度下该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是____ _ _ ___。
(3) 甲烷燃料电池可以提升能量利用率,下图是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:
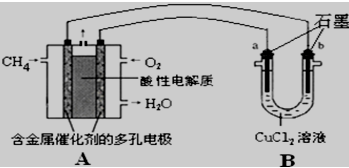
请回答:
①甲烷燃料电池的负极反应式是
②当A中消耗0.15mol氧气时,B中 (用a或b 表示)极增重 g.
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为。
②反应B+A→C的离子方程式为。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为(填化学式),此时图b中x7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。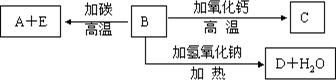
请填空:
(1)形成单质A的原子的结构示意图为,它的最高化合价为。
(2)B的化学式(分子式)为,B的晶体类型为。
B和碳反应生成A和E的化学方程式是。
(3)C的化学式(分子式)为,D的化学式(分子式)为。
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-→ NO+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是______________________。
(1)已知断开1 mol H2中的化学键需吸收436 kJ热量,断开1 mol Cl2中的化学键需要吸收243 kJ能量,而形成1 molHCl分子中的化学键要释放431 kJ能量,试求1 mol H2与1 mol Cl2反应的能量变化。△H= 。
(2)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的PH=___①___,此酸的电离平衡常数K=___②___,由HA电离出来的H+的浓度约为水电离出来的H+的浓度的__③__倍。
(1)甲同学用一种标准盐酸去测定一种未知浓度的氨水溶液的浓度,应选用___①___作指示剂,滴定终点溶液颜色变化__②___,若用待测液润洗锥形瓶,则所测的氨水溶液浓度(以下用偏高,偏低,无影响填空)___③__,若酸式滴定管在用蒸馏水洗净后没有用标准盐酸润洗,则所测氨水的溶液浓度__④___,若酸式滴定管滴定前读数正确,滴定后俯视读数,则所测氨水的溶液浓度__⑤___。
(2)PH相同的盐酸和硫酸溶液分别用蒸馏水稀释至原来的m 倍和n倍,稀释后两溶液的PH仍相同,则m __①___ n(选填> 、< 、 =),若改用PH相同的氨水和氢氧化钠溶液溶液,进行上述操作,则m __②___ n(选填 > 、< 、 =)。